| סרקומת תאים דנדריטים זקיקים | |
|---|---|
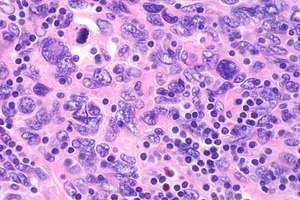 | |
| מיקרוגרף מראה סרקומה של תאי דנדריטים זקיקים. התאים הסרטניים גדולים יותר ויש להם גרעינים מכתים חיוורים. הקטן יותר (שפיר) שזור לימפוציטים (כחול כהה יותר) שכיחים ומציעים את האבחנה. כתם H&E. | |
| תחום התמחות | אונקולוגיה |
סרקומת תאים דנדריטים זקיקים (FDCS) הוא נדיר ביותר ניאופלזמה. אמנם קיומם של גידולי FDC נחזה על ידי לנרט בשנת 1978, אך הגידול לא הוכר במלואו כסרטן שלו עד 1986 לאחר אפיונו על ידי Monda et al.[1][2] זה מהווה רק 0.4% מהרקמות הרכות סרקומות, אך בעל פוטנציאל חוזר וגרורתי משמעותי ונחשב לממאירות בדרגת ביניים.[3] המכשול העיקרי בטיפול ב- FDCS היה אבחון שגוי. זהו סרטן שאופיין לאחרונה, ובגלל הדמיון שלו במצגת ובסמנים שלו לימפומה, גם תת-סוגים של הודג'קין וגם של לא-הודג'קין, אבחנה של FDCS יכולה להיות קשה.[4] עם ההתקדמות האחרונה בביולוגיה של סרטן נעשו מבחני אבחון טובים יותר וגורמים כימותרפיים לאבחון וטיפול מדויקים יותר ב- FDCS.[צורך בציטוט ]
סימנים וסימפטומים
תאים דנדריטים זקיקים ממוקמים במרכזים נבטיים של זקיקי הלימפה ויש להם תפקיד בלתי נפרד בוויסות התגובה של מרכז הנבטים ומציגים אנטיגנים לתאי B.[5][6] מרבית המקרים של FDCS מתפתחים בבלוטות הלימפה, אך כ -30% מתפתחים באתרים חוץ-טבעיים. בשנת 1998 המחקר הגדול ביותר על המחלה היה סקירה רטרוספקטיבית עם חמישים ואחת חולים.[7] מבין חמישים ואחת חולים אלה לא נמצא דפוס חלוט ביחס לגיל, מין, גזע או מצגת. הגיל החציוני של המטופל היה 41 (טווח 14-76), ולמרות שרוב המקרים הוצגו עם צוואר הרחם לימפדנופתיה של השחי, 17 הוצגו באתרים חוץ-טבעיים הכוללים כבד, טחול, מעי ולבלב.[7] עם מגוון כזה של היסטוריות חולים לא נקשרה סיבה מוחלטת ל- FDCS. עם זאת, היו עדויות לכך שחשיפה קודמת ל וירוס אפשטיין בר (EBV) או אבחון של מחלת קסטלמן יכול להגדיל את הסיכון לפתח FDCS - ספרות רפואית בשנת 2000 דיווחה כי כ- 12% מכל המקרים של גידולי FDC קשורים ל- EBV, עם שונות באיברים שונים, אך תפקיד EBV נותר לא ברור בפתוגנזה של גידול ב- FDC; נראה ש- EBV לא ממלא תפקיד בתהליך ההפיכה של מחלת קסטלמן לסרקומה של FDC מכיוון שכל המקרים שהדיווח שנמצא קשור למחלת קסטלמן היו שליליים ב- EBV.[8][9][10]
הסימפטומים של FDCS משתנים, ותלויים במידה רבה בחלק בגוף בו מתפתח הגידול. התסמין השכיח ביותר הוא נפיחות ללא כאבים בבלוטות הלימפה. אולם תסמין זה בלבד אינו מוחלט מכיוון שהוא קשור למחלות רבות אחרות, כולל הצטננות. תסמינים נוספים כוללים שיעול, כאב גרון, קשיי בליעה, ירידה במשקל ועייפות. במקרים המופיעים באתרים חוץ-טבעיים מחוץ לאזור הראש והצוואר, נצפים תסמינים ספציפיים לאיברים.[צורך בציטוט ]
אִבחוּן
הַכתָמָה
התפשטות תאי FDC אופיינית לתנאים ניאופלסטיים רבים כולל היפרפלזיה זקיקית, לימפומה זקיקית, לימפוציט נודולרי שולט במחלת הודג'קין ו לימפומה של תאי T אנגיואימונובלסטיים.[11] למרות שהוכרה סוף סוף כמחלה שלה בשנת 1986, האבחנה של FDCS עדיין קשה. תאי ה- FDC גדולים, מכילים שני גרעינים ויוצרים אשכולות עם לימפוציטים המקשים על הבחנתם במכתים. תאים אלו מוצגים בצורה הטובה ביותר עם צביעה חיסונית באמצעות סמני FDC CD21, CD35, R4 / 23, clusterin ו- KiM4p.[11] ניתוח סמנים הביא גם לוויכוח על מקור סוג התא; הוא מבטא יחד את CD45, אנטיגן שכיח של לויקוציטים, ו- CD15, אנטיגן נפוץ של מונוציטים.[7] בגלל הוויכוח והקושי להכתים, אבחון פתולוגי דורש לעיתים קרובות גם ניתוח מיקרוסקופ מורפולוגי, ציטוכימי ואלקטרוני.[7]
מוטציות סלולריות
הפרעות תאיות שנמצאו בגידול FDCS נוצלו למטרות אבחון. באופן אופייני, ל- FDCS יש מבנים mircotubuloreticular (MTRS) ורמות מוגברות של תאיים אשכול.[12][13] MTRS תורמים ל מיקרו-צינור היווצרות של מבנים רבים, כולל הציר המיטוטי, במהלך חלוקת התאים. זה תורם לרבים מסימני ההיכר של סרטן, כולל איתות ריבוי, הפעלת גדילה ואלמוות שכפול.[14] קלסטרין הוא חלבון הטרודימרי המסייע בפינוי פסולת תאית ומעורב באפופטוזיס. קלסטרין יכול להיות מוכתם כדי לעזור להבחין בין FDCS והוא מעורב בסימני ההיכר הרבים החשובים של סרטן, כולל עמידות למוות של תאים והעלמת מדכאי גדילה.[14]
יַחַס
לִקצוֹץ
בזמן גילוי סרקומה של תאי הדנדריטים הזקיקים, המידע על השפעת הכימותרפיה והקרנות עליה לא היה קיים. מיטב הרופאים שהיו יכולים לעשות היה לנסות חומרים כימותרפיים קיימים. ללא כל עדות ליתרון הקליני של כימותרפיה, רבים מהמקרים הראשונים טופלו אך ורק בכריתה מלאה ו / או בהקרנות. עם זאת, 12 מתוך 31 חולים שעברו ניתוח לבד כטיפול ראשוני חזרו על עצמם.[7] מבין החולים שקיבלו ניתוח והקרנות, 2 מתוך 8 חזרו על עצמם.[7] התברר כי דרושות אפשרויות טיפול טובות יותר. בהיותם דומים כל כך ללימפומות, רופאים החלו להשתמש במשטר כימותרפיה שכיחה בליוקמיה נפוצה ובלימפומה שאינה הודג'קין בחולי FDCS: לִקצוֹץ.[צורך בציטוט ]

משטר ה- CHOP מורכב מ- ציקלופוספמיד, דוקסורוביצין, אונקובין, ו פרדניזון (לִקצוֹץ). כולם מנצלים מסלולים שונים הנפוצים בתאים סרטניים. ציקלופוספמיד מאט או מפסיק את צמיחת התאים. הוא מכוון לתאים שמתחלקים במהירות, הכוללים תאים סרטניים המספקים את עצמם באותות גדילה ואינם רגישים לאותות אנטי-צמיחה. חשוב מכך, הפעולות הביולוגיות של ציקלופוספמיד תלויות במינון.[15] במינונים גבוהים זה מאוד ציטוטוקסי; פוספורומיד המטבוליט שלה מוסיף קבוצת אלקיל למצב N7 על הגואנין וכתוצאה מכך גדלה עצורה ומוות תאים. המטבוליט נוצר רק בתאים עם רמות נמוכות של אלדהיד דהידרוגנאז ציטופלזמי (ALDH), וכתוצאה מכך רעילות כימותרפית נמוכה יחסית בתאים שאינם סרטניים כמו מוח עצם. זה גם מדכא חיסון ומקטין את התגובה הדלקתית. במינונים נמוכים, בעוד שהוא פחות ציטוטוקסי, הוא מראה כמה תכונות אנטי-אנגיוגניות. המנגנון אינו מובן לחלוטין; חושבים שהוא מפריע לגורמי הצמיחה של VEGF המיוצרים בסביבת המיקרו-סביבה.[16]
דוקסורוביצין מפריע לצמיחת תאים ולשכפולם על ידי השתלבות ב- DNA. זה מונע מ- Topoisomerase II להרפות את גדילי ה- DNA ומעכב תעתיק. מחקרים אחרונים הראו כי דוקסורוביצין עשוי להיות מעורב ב מסלול PI3K / AKT / mTOR.[17] סימן היכר חשוב לסרטן, Akt הוא חלק ממסלולי הישרדות התאים על ידי עיכוב אפופטוזיס. יש גם עדויות לכך אקט מעורב באנגיוגנזה ובהבשלה בכלי הדם.[18] הפעלת מסלול PI3K / AKT / mTOR מתווכת ייצור VEGF בתאים.[18] לכן, לדוקסורוביצין תפקיד כפול בטיפול בסרטן: הוא מעכב את הישרדות התאים (גורם לאפופטוזיס), ומקטין את האנגיוגנזה.[צורך בציטוט ]
אונקובין, הידוע יותר בכינויו וינקריסטין, הוא מעכב מיטוטי. הוא נקשר לדימרים של טובולין, ומעכב את הרכבת מבני המיקרו-צינור כמו השלד הציטודי והציר המיטוטי. למרות שתרופה זו עדיין אינה יכולה למקד בקפידה לתאים סרטניים, תאים סרטניים מחליפים ממיקרו-צינורות גבוהים יותר, מה שהופך אותם לרגישים יותר לציטוטוקסיות של אונקובין. פרדניזון, התרופה האחרונה בטיפול משולב ב- CHOP הוא סטרואידים הפועלים כמדכא חיסוני.[צורך בציטוט ]
למרות שחלק מהתוצאות נצפו בחולי FDCS שטופלו ב- CHOP, הם היו רחוקים מלהיות עקביים. שימוש במשטר כימותרפי המיועד לסרטן אחר הוא דרך ארכאית של "ניחוש ובדיקה" לטיפול במחלה. בשנת 2008 הסקירה הגדולה ביותר של FDCS פורסמה כניתוח בדיעבד על 98 חולים והמחברים המליצו כי ניתוח ללא טיפול אדג'ובנטי יהיה הסטנדרט לטיפול ב- FDCS.[19] חולים שטופלו בניתוח בלבד היו בעלי הישנות של 40% ואלה שטופלו בטיפול משלים לאחר הניתוח לא היו בעלי הישנות שונה באופן משמעותי.[19] לקרינה ו / או כימותרפיה לא הייתה השפעה משמעותית בשיפור הישרדותם ללא מחלות של חולים. עם זאת, עם ההתפתחויות בהבנתנו את סימני ההיכר של סרטן, מפותחות גישות חדשות להתמקדות וטיפול ספציפיים ב- FDCS.[צורך בציטוט ]
(PEG) דוקסורוביצין ליפוזומלי
התפתחות אחת כזו היא במתן דוקסורוביצין. אמנם זהו גורם יעיל לאפופטוזיס, אך הדוקסורוביצין מסונן במהירות מהגוף. על ידי העמסת ליפוזום PEG עם דוקסורוביצין זמן המחזור והלוקליזציה לגידולים גדלים מאוד.[3] לגידולים סרטניים באופן אופייני יש אנגיוגנזה נרחבת וכלי דם דולפים, מה שגורם לליפוזומי PEG להצטבר באופן טבעי בגידול. זה גם מאפשר לחולים לקבל מנות נמוכות ופחות יותר של התרופה ולחוות פחות תופעות לוואי.
טקסוטר וג'מציטאבין

מקרים חדשים יותר מתחילים להיות מטופלים גם על ידי טקסוטר ו gemcitabine. הטקסוטר דומה לאונקובין המשמש ב- CHOP; זה קושר באופן בלתי הפיך את בטא טובולין הפוסק ביצירת מיקרו-צינורות. לטקסוטר יש הטבה נוספת; זה גם זרחן bcl-2 כדי לעצור את המסלול האנטי-אפופטוטי.[20] ההשפעה הכפולה של הטקסוטר על מסלולי סרטן אינטגרליים הופכת אותו לתרופה חזקה יותר מאונקובין. Gemcitabene הוא אנלוגי נוקלאוזיד וכאשר הוא משולב ב- DNA במהלך השכפול מוביל לאפופטוזיס; הפלואור באטום הפחמן 2 'מונע היקשרות של נוקלאוזידים אחרים.[21] החלק החשוב ביותר בטיפול משולב זה, לעומת זאת, הוא הסינרגיה בין התרופות. החוקרים אמנם אינם בטוחים לחלוטין במנגנון, אך ישנן עדויות להשפעות סינרגיסטיות של טקסוטר וגמציטאבין כאשר משתמשים בהן בשילוב.[22][23] זה מאפשר ירידה במינונים של כל גורם יחיד עם תגובה אפופטוטית מוגברת.[צורך בציטוט ]
מחקר
כל ההתקדמות בהבנת וטיפול ב- FDCS נובעת מהתקדמות שנעשתה בסרטן אחר. קשה להשיג מימון למחקר ולהיות סרטן כזה נדיר FDCS אינו מקבל עדיפות כספית. CHOP, Gemcitabine ו- Taxotere פותחו בתחילה עבור סוגי סרטן אחרים, אך מסלולים שעברו מוטציה הדדית מאפשרים להשתמש בהם ב- FDCS. סימני ההיכר של סרטן סייעו לרופאים להבין שישנם המשותף הביולוגי בין סוגי סרטן שונים לכאורה, שניתן לנצל אותם לפיתוח תכניות טיפול חדשות וטובות יותר.[14]
הפניות
- ^ לנרט, קארל (1978). לימפומות ממאירות שאינן מחלת הודג'קין, היסטולוגיה, ציטולוגיה, אולטרא-סטרוקטורה, אימונולוגיה. ברלין: ספרינגר-ורלאג. עמ '59–64. ISBN 978-0-387-08020-8.
- ^ מונדה, לורן; וורנק, רוג'ר; רוזאי, חואן (1986). "ממאירות ראשונית בבלוטת הלימפה עם תכונות המרמזות על בידול תאי רטיקולום דנדריטים. דוח על 4 מקרים". כתב העת האמריקני לפתולוגיה. 122 (3): 562–72. PMC 1888214. PMID 2420185.
- ^ א ב שארפ, מרים; איסטהופ, סטפני א .; קיטינג, גיליאן מ.; Lamb, Harriet M. (2002). "דוקסורוביצין פוליאתילן גליקול-ליפוזומלי: סקירה של השימוש בו לניהול ממאירות מוצקה והמטולוגית וסרקומה של קפוסי הקשורה לאיידס".. סמים. 62 (14): 2089–126. דוי:10.2165/00003495-200262140-00012. PMID 12269857.
- ^ פונסקה, רפאל; טפרי, איילו; סטריקלר, ג'ון ג'י (1997). "סרקומה של תאי הדנדריטים הזקיקים המחקה לימפומה של תאים גדולים מפוזרים: דוח מקרה". כתב העת האמריקני להמטולוגיה. 55 (3): 148–55. דוי:10.1002 / (SICI) 1096-8652 (199707) 55: 3 <148 :: AID-AJH6> 3.0.CO; 2-S. PMID 9256295.
- ^ קוסקו, מארי ה.; גריי, דייוויד (1992). "איתותים המעורבים בתגובות של מרכז הנבטים". ביקורות אימונולוגיות. 126: 63–76. דוי:10.1111 / j.1600-065X.1992.tb00631.x. PMID 1597321.
- ^ תו, ג'ון ג '; קוסקו, מארי ה.; ברטון, גרגורי פ.; Szakal, Andras K. (1990). "תאים דנדריטים זקיקים כתאי אבזר". ביקורות אימונולוגיות. 117: 185–211. דוי:10.1111 / j.1600-065X.1990.tb00573.x. PMID 2258191.
- ^ א ב ג ד ה f פונסקה, ר '; יאמאקאווה, מ '; נקאמורה, ש. ואן הרדה, פ '; מיטינן, מ '; שק, T.W. ח .; ג'נסן, או 'מיירה; רוסלט, מ 'ג'; Tefferi, A. (1998). "סרקומה של תאי דנדריטים פוליקולריים וסרקומת של תאי רשתית interdigitating: סקירה". כתב העת האמריקני להמטולוגיה. 59 (2): 161–7. דוי:10.1002 / (SICI) 1096-8652 (199810) 59: 2 <161 :: AID-AJH10> 3.0.CO; 2-C. PMID 9766802.
- ^ בידל, דייויד א .; רו, ג'ה י. יון, גיל ס. יונג, יאפ-וונג ח '; אילה, אלברטו ג'י; אורדונז, נלסון ג'י. Ro, J (2002). "סרקומת תאים דנדריטים פוליקולריים חוץ-גולגולת באזור הראש והצוואר: שלושה מקרים חדשים, עם סקירת הספרות". פתולוגיה מודרנית. 15 (1): 50–8. דוי:10.1038 / modpathol.3880489. PMID 11796841.
- ^ חן צי-צ'ינג; קו צנג-טונג; נג קוואי-פונג (2001). "גידול תאי דנדריטים פוליקולריים של הכבד: מחקר קליני-פתולוגי וירוס אפשטיין-בר בשני מקרים". פתולוגיה מודרנית. 14 (4): 354–360. דוי:10.1038 / modpathol.3880315. PMID 11301353.
- ^ הוריגוצ'י ה.; Matsui-Horiguchi M .; סקאטה ה '; Ichinose M .; יאמאמוטו ט.; פוג'יווארה מ.; אוסה ה '(פברואר 2004). "גידול תאי דנדריטים פוליקולריים דמויי pseudotumor של הטחול". פתולוגיה בינלאומית. 54 (2): 124–131. דוי:10.1111 / j.1440-1827.2004.01589.x. PMID 14720144.
- ^ א ב צ'אן, ג'ון ק. ג .; פלטשר, כריסטופר ד. מ. ניילר, סיימון י. קופר, קום (1997). "סרקומת תאים דנדריטים זקיקים". מחלת הסרטן. 79 (2): 294–313. דוי:10.1002 / (SICI) 1097-0142 (19970115) 79: 2 <294 :: AID-CNCR13> 3.0.CO; 2-W. PMID 9010103.
- ^ אונו, יורי; טרשימה, קזואו; ליו, איימין; יוקויאמה, מונייהירו; יוקושימה, קאזוהירו; מיזוקאמי, מיקי; ווטנאבה, קן; מוצ'ימארו, יוקו; ואח '. (2009). "סרקומה של תאי דנדריטים פוליקולריים עם מבנה מיקרוטוברולורטיקולרי וייצור חלקיקים דמויי וירוס במבחנה". פתולוגיה בינלאומית. 59 (5): 332–44. דוי:10.1111 / j.1440-1827.2009.02375.x. PMID 19432677.
- ^ גרוג, קארן ל; מקון, וויליאם ר; קורטין, פול ג'יי; נאסימנטו, אנטוניו ג'י (2004). "סקר של ביטוי קלסטרין ומרתק בסרקומות ובניאופלזמות של תאי ציר: צביעה חיסונית חזקה של אשכולות ספציפית מאוד לגידול תאי דנדריטים זקיקים". פתולוגיה מודרנית. 18 (2): 260–6. דוי:10.1038 / modpathol.3800294. PMID 15467709.
- ^ א ב ג האנהן, דאגלס; וויינברג, רוברט א '(2011). "סימני ההיכר של סרטן: הדור הבא". תָא. 144 (5): 646–74. דוי:10.1016 / j.cell.2011.02.013. PMID 21376230.
- ^ ניקוליני, א; מנצ'יני, פ; פרארי, פ; אנסלמי, ל; טרטרלי, ג'י; בונאזי, וי; קרפי, א; ג'יארדינו, ר '(2004). "ציקלופוספמיד במינון נמוך דרך הפה בסרטן ערמונית עקב הורמונים גרורתי (MHRPC)". ביו-רפואה ופרמקותרפיה. 58 (8): 447–50. דוי:10.1016 / j.biopha.2004.08.006. PMID 15464874.
- ^ נליוס, תומאס; קלטה, טוביאס; ריזה, ורנר; היינס, אלן; פילור, סטפני (2009). "תוצאה קלינית של חולים עם סרטן ערמונית עמיד להורדת דוקטקסל שטופלו בכימותרפיה מטרונומית מבוססת ציקלופוספמיד בשורה השנייה". אונקולוגיה רפואית. 27 (2): 363–7. דוי:10.1007 / s12032-009-9218-8. PMID 19365737.
- ^ וונדל, הנס-גואידו; סטנצ'ינה, אליסה דה; פרידמן, ג'ורדן ש. מלינה, אבא; ריי, סאגאריקה; קוגן, סקוט; קורדון-קרדו, קרלוס; פלטייה, ג'רי; לואו, סקוט וו. (2004). "איתות הישרדות על ידי Akt ו- eIF4E באונקוגנזה וטיפול בסרטן". טֶבַע. 428 (6980): 332–7. ביבקוד:2004 נאטור 428..332 וו. דוי:10.1038 / nature02369. PMID 15029198.
- ^ א ב חן, ג'והואה; Somanath, Payaningal R; רזורנובה, אולגה; חן, וויליאם S; היי, ניסים; בורנשטיין, פול; ביזובה, טטיאנה החמישית (2005). "Akt1 מווסת אנגיוגנזה פתולוגית, התבגרות כלי דם וחדירות in vivo". רפואה טבעית. 11 (11): 1188–96. דוי:10.1038 / nm1307. PMC 2277080. PMID 16227992.
- ^ א ב Depas, T; ספיטלרי, ז '; Pruneri, G; קוריליאנו, ג'י; נוברסקו, ג; לואיני, א; אנדריוני, ב; טסטורי, א; Debraud, F (2008). "סרקומת תאים דנדריטים: סקירה אנליטית של הספרות והצגת חמשת המקרים המקוריים". ביקורות קריטיות באונקולוגיה / המטולוגיה. 65 (1): 1–7. דוי:10.1016 / j.critrevonc.2007.06.003. PMID 17658269.
- ^ פאתן, נ. איימה-סמפה, ג; קיטאדה, S; באסו, א; הלדר, ש; ריד, ג'יי.סי (2001). "תרופות המכוונות למיקרו-צינורות גורמות לזרחת Bcl-2 ולשיוך עם Pin1". ניאופלזיה. 3 (6): 550–9. דוי:10.1038 / sj.neo.7900213. PMC 1506558. PMID 11774038.
- ^ מיני, E .; נובילי, ס; Caciagli, B; לנדיני, אני; Mazzei, T (2006). "פרמקולוגיה סלולרית של ג'מציטאבין". תולדות האונקולוגיה. 17: v7–12. דוי:10.1093 / annonc / mdj941. PMID 16807468.
- ^ Leu, K. M .; Ostruszka, LJ; Shewach, D; Zalupski, M; סונדק, וי; בירמן, JS; לי, ג'יי.אס; Couwlier, C; ואח '. (2004). "עדויות מעבדה וקליניות של ציטוטוקסיות סינרגטית של טיפול ברצף עם גמציטאבין ואחריו דוקטקסל בטיפול בסרקומה". כתב העת לאונקולוגיה קלינית. 22 (9): 1706–12. דוי:10.1200 / JCO.2004.08.043. PMID 15117993.
- ^ מפרץ, ז'אק-אוליבייה; ריי-קוקארד, איזבל; פייט, ג'רום; לייוורז, סרג '; שריקס, סטפן; פיפרנו-נוימן, סופי; שבראו, כריסטין; איזמברט, ניקולה; ואח '. (2006). "שילוב של Docetaxel ו- gemcitabine ב -133 סרקומות רקמות רכות מתקדמות: ניתוח רטרוספקטיבי". כתב העת הבינלאומי לסרטן. 119 (3): 706–11. דוי:10.1002 / ijc.21867. PMID 16496406.
קישורים חיצוניים
| מִיוּן | |
|---|---|
| משאבים חיצוניים |
