

ה שכבה דו-שכבתית (אוֹ דו שכבתי פוספוליפי) הוא דק קרום קוטבי עשוי משתי שכבות של שומנים בדם מולקולות. הממברנות הללו הן יריעות שטוחות המהוות מחסום מתמשך מסביב לכל תאים. ה קרומי תאים של כמעט כולם אורגניזמים ורבים וירוסים עשויים דו שכבתי שומני, כמו גם ממברנה גרעינית המקיף את גרעין התא, ו קרומים של ה אברונים הקשורים לקרום בתא. שכבת הדו-שכבה השומנית היא המחסום שנשמר יונים, חלבונים ומולקולות אחרות שבהן יש צורך בהן ומונע מהן להתפשט לאזורים שבהם הם לא צריכים להיות. שכבות דו-שכבות בשומנים בדם מתאימות באופן אידיאלי לתפקיד זה, למרות שהן רק מעטות ננומטרים ברוחב,[1] מכיוון שהם אטומים לרוב המסיסים במים (הידרופילי ) מולקולות. שכבות כוסיות חדירות במיוחד ליונים, מה שמאפשר לתאים לווסת את ריכוזי המלח ו pH על ידי הובלת יונים על פני קרומיהם באמצעות חלבונים הנקראים משאבות יונים.
שכבות דו-שכבתיות ביולוגיות מורכבות בדרך כלל מ אמפיפי פוספוליפידים שיש להם ראש פוספט הידרופילי ו- הידרופובי זנב המורכב משתי שרשראות חומצות שומן. פוספוליפידים עם קבוצות ראש מסוימות יכולים לשנות את כימיה פני השטח של שכבה דו-שכבתית ויכולים למשל לשמש כאותות כמו גם "עוגנים" למולקולות אחרות בקרומי התאים.[2] בדיוק כמו הראשים, גם זנבות השומנים יכולים להשפיע על תכונות הממברנה, למשל על ידי קביעת ה- שלב של הדו-שכבתי. הדו-שכבתי יכול לאמץ מוצק לְהַגלִיד מצב פאזה בטמפרטורות נמוכות יותר אך עובר מעבר פאזה אל א מצב נוזלי בטמפרטורות גבוהות יותר, והתכונות הכימיות של זנבות השומנים משפיעות על איזו טמפרטורה זה קורה. אריזת השומנים בתוך שכבת הדו-שכבה משפיעה גם על תכונותיה המכניות, כולל עמידותה בפני מתיחה וכיפוף. רבות מהמאפיינים הללו נחקרו תוך שימוש בשכבות דו-מלאכותיות "מודל" המיוצרות במעבדה. שלפוחיות שיוצרו על ידי שכבות מודל שימשו גם קלינית להעברת תרופות.
ממברנות ביולוגיות בדרך כלל כוללים כמה סוגים של מולקולות שאינן פוספוליפידים. דוגמה חשובה במיוחד בתאי בעלי חיים היא כולסטרול, אשר מסייע בחיזוק הדו-שכבתי ובהפחתת החדירות שלו. כולסטרול גם מסייע בוויסות הפעילות של מסוימים חלבוני קרום אינטגרליים. חלבוני קרום אינטגרליים פועלים כאשר הם משולבים בשכבה דו-שכבתית, והם מוחזקים בחוזקה לשכבת הדו-שכבתית בעזרת קליפת שומנים טבעתית. מכיוון ששכבות דו-שכבתיות מגדירות את גבולות התא ותאיו, חלבוני הממברנה הללו מעורבים בתהליכי איתות פנים-בין-תאיים רבים. סוגים מסוימים של חלבוני קרום מעורבים בתהליך איחוי שני שכבות דו שכבתיות יחד. היתוך זה מאפשר צירוף של שני מבנים מובחנים כמו ב תגובה אקרוזומית בְּמַהֲלָך הַפרָיָה של ביצה על ידי א זֶרַע, או הכניסה של a נגיף לתא. מכיוון ששתי שכבות שומנים בדם שבריריות ואינן נראות במיקרוסקופ מסורתי, הם מהווים אתגר ללמוד. ניסויים בשכבות דו-שכבתיות דורשים לרוב טכניקות מתקדמות כמו אלקטרון מיקרוסקופי ו מיקרוסקופ כוח אטומי.
מבנה וארגון
כאשר פוספוליפידים נחשפים למים, הם הרכבה עצמית ליריעה דו-שכבתית כשהזנבות ההידרופוביים מכוונים לעבר מרכז היריעה. הסדר זה מביא לשני "עלונים" שהם כל אחד מהם שכבה מולקולרית אחת. מרכז שכבת הדו-שכבה הזו כמעט ואינו מכיל מים ואינו כולל מולקולות כמו סוכרים או מלחים שמתמוססים במים. תהליך ההרכבה מונע על ידי אינטראקציות בין מולקולות הידרופוביות (המכונות גם אפקט הידרופובי ). עלייה באינטראקציות בין מולקולות הידרופוביות (הגורמות לאשכול אזורים הידרופוביים) מאפשרת למולקולות מים להיקשר בצורה חופשית יותר זו עם זו, מה שמגדיל את האנטרופיה של המערכת. תהליך מורכב זה כולל אינטראקציות לא קוולנטיות כמו כוחות ואן דר וואלס, אלקטרוסטטי ו קשרי מימן.
ניתוח חתך רוחב

שכבת הדו-שכבה השומנית דקה מאוד בהשוואה לממדים הרוחביים שלה. אם תא יונקים טיפוסי (קוטר ~ 10 מיקרומטר) הוגדל לגודל אבטיח (~ 1 רגל / 30 ס"מ), שכבת השומנים המרכיבה את קרום פלזמה יהיה עבה בערך כמו נייר משרדי. למרות עוביו של כמה ננומטרים בלבד, שכבת הדו-שכבה מורכבת מכמה אזורים כימיים נפרדים על פני חתך רוחבו. אזורים אלה והאינטראקציה שלהם עם המים הסובבים אופיינו במהלך העשורים האחרונים עם רפלקטריית רנטגן,[4] פיזור נויטרונים[5] ו תהודה מגנטית גרעינית טכניקות.
האזור הראשון משני צידי שכבת הדו שכבתית הוא קבוצת הראש ההידרופילית. חלק זה של הממברנה מיובש לחלוטין והוא בדרך כלל בעובי של 0.8-0.9 ננומטר. ב פוספוליפיד שכבות דו - צדדיות פוֹספָט הקבוצה ממוקמת באזור מיובש זה, כ 0.5 ננומטר מחוץ לליבה ההידרופובית.[6] במקרים מסוימים, האזור המוזר יכול להתרחב הרבה יותר, למשל בשומנים עם חלבון גדול או שרשרת סוכר ארוכה המושתלים לראש. אחת הדוגמאות הנפוצות לשינוי כזה בטבע היא ליפופוליסכריד מעיל על קרום חיצוני חיידקי,[7] המסייע בשמירה על שכבת מים סביב חיידק כדי למנוע התייבשות.

ליד האזור הממוזג נמצא אזור ביניים שעובר לחות חלקית בלבד. עובי שכבת גבול זו הוא 0.3 ננומטר בערך. במרחק קצר זה, ריכוז המים יורד מ -2 מיליון בצד קבוצת הראש לכמעט אפס בצד הזנב (הליבה).[8][9] הליבה ההידרופובית של שכבת הדו-שכבה היא בעובי של 3-4 ננומטר, אך ערך זה משתנה עם אורך השרשרת וכימיה.[4][10] עובי הליבה משתנה משמעותית גם עם הטמפרטורה, בפרט ליד מעבר פאזה.[11]
אָסִימֵטְרִיָה
בשכבות דו שכבתיות רבות המופיעות באופן טבעי, ההרכבים של עלוני הממברנה הפנימיים והחיצוניים שונים. באנושי תאי דם אדומים, העלון הפנימי (הציטופלזמי) מורכב ברובו מ פוספטידיל אתנולמין, פוספטידיל סרין ו פוספטידילינוזיטול ונגזרותיו הזרחניות. לעומת זאת, העלון החיצוני (חוץ-תאי) מבוסס על פוספטידילכולין, ספינגומיאלין ומגוון גליקוליפידים.[12][13] בחלק מהמקרים אסימטריה זו מבוססת על המקום בו מייצרים את השומנים בתא ומשקף את האוריינטציה הראשונית שלהם.[14] הפונקציות הביולוגיות של אסימטריה בשומנים אינן מובנות בצורה מושלמת, אם כי ברור שהיא משמשת בכמה מצבים שונים. לדוגמא, כאשר תא עובר אפופטוזיס, הפוספטידילסרין - הממוקם בדרך כלל בעלון הציטופלזמי - מועבר למשטח החיצוני: שם הוא מוכר על ידי מקרופאג ואז מוציא את התא הגוסס באופן פעיל.
א-סימטריה של ליפידים נובעת, לפחות חלקית, מהעובדה שרוב הפוספוליפידים מסונתזים ומוחדרים בתחילה לשכבה הפנימית: אלה המהווים את שכבת החד-שכבה החיצונית מועברים לאחר מכן מהשכבה הפנימית על ידי סוג של אנזימים הנקראים flippases.[15][16] נראה כי שומנים אחרים, כגון ספינגומיאלין, מסונתזים בעלון החיצוני. Flippases הם בני משפחה גדולה יותר של מולקולות הובלת שומנים הכוללים גם floppases, המעבירים ליפידים בכיוון ההפוך, ו scramblases, אשר מקריעים אקראית את התפלגות השומנים על פני שכבות דו שומניות (כמו בתאים אפופטוטיים). בכל מקרה, ברגע שנקבעה אסימטריה של ליפידים, היא בדרך כלל לא מתפוגגת במהירות מכיוון שכפכף ספונטני של ליפידים בין העלונים איטי ביותר.[17]
ניתן לחקות א-סימטריה זו במעבדה במערכות דו שכבתיות מודל. סוגים מסוימים של מלאכותיים קטנים מאוד שַׁלפּוּחִית יהפכו את עצמם אוטומטית למעט לא סימטריים, אם כי המנגנון שבאמצעותו נוצרת חוסר סימטריה זה שונה מאוד מזה שבתאים.[18] באמצעות שני שכבות חד שכבתיות שונות ב לנגמויר-בלודגט תַצהִיר[19] או שילוב של Langmuir-Blodgett ותצהיר קרע שלפוחית[20] אפשר גם לסנתז דו שכבתי מישורי אסימטרי. חוסר סימטריה זה עלול ללכת לאיבוד לאורך זמן מכיוון ששומנים בשכבה דו-שכבתית נתמכים יכולים להיות נוטים לכפכף.[21]
שלבים ומעברי פאזה

בטמפרטורה נתונה שכבת דו-שכבתית יכולה להתקיים בשלב נוזלי או ג'ל (מוצק). לכל השומנים הטמפרטורה האופיינית בה הם עוברים (נמסים) משלב הג'ל לנוזל. בשני השלבים מונעת ממולקולות השומנים להעיף את שכבת הדו-שכבה, אך בשכבה דו-שכבתית של נוזלים שומנים מסוימים יחליפו מיקומים עם שכנתו מיליוני פעמים בשנייה. זֶה הליכה אקראית החלפה מאפשרת לשומנים מְפוּזָר וכך לשוטט על פני הקרום.[22] בניגוד לשתי שכבות פאזה נוזליות, לשומנים בשכבה דו-שכבתית ג'ל יש פחות ניידות.
התנהגות פאזה של שכבות דו שומניות נקבעת במידה רבה על ידי כוח המשיכה ואן דר ואלס אינטראקציות בין מולקולות ליפידים סמוכות. לשומנים ארוכי זנב יש יותר שטח שעליהם ניתן לקיים אינטראקציה, מה שמגביר את חוזק האינטראקציה הזו וכתוצאה מכך מקטין את ניידות השומנים בדם. לפיכך, בטמפרטורה נתונה, ליפיד קצר זנב יהיה נוזלי יותר מאשר ליפיד ארוך זנב זהה אחרת.[10] טמפרטורת המעבר יכולה להיות מושפעת גם מה- דרגת חוסר רוויה של זנבות השומנים בדם. בלתי רווי קשר כפול יכול לייצר כיור בתוך אלקן שרשרת, משבשת את אריזת השומנים בדם. שיבוש זה יוצר שטח פנוי נוסף בתוך שכבת הדו-שכבה המאפשר גמישות נוספת ברשתות הסמוכות.[10] ניתן לציין דוגמה לאפקט זה בחיי היומיום כי חמאה, שיש בה אחוז גדול של שומנים רוויים, היא מוצקה בטמפרטורת החדר ואילו שמן צמחי, שהוא לרוב בלתי רווי, הוא נוזלי.
רוב הממברנות הטבעיות הן תערובת מורכבת של מולקולות שומניות שונות. אם חלק מהרכיבים נוזליים בטמפרטורה נתונה בעוד שאחרים נמצאים בשלב הג'ל, שני השלבים יכולים להתקיים במקביל באזורים המופרדים במרחב, כמו קרחון שצף באוקיאנוס. הפרדת פאזה זו ממלאת תפקיד קריטי בתופעות ביוכימיות מכיוון שרכיבי קרום כגון חלבונים יכולים להתחלק לשלב כזה או אחר[23] וכך להיות מרוכזים או מופעלים מקומית. מרכיב חשוב במיוחד במערכות שלבים מעורבים רבים הוא כולסטרול, שמווסת את החדירות הדו-שכבתית, חוזק מכני ואינטראקציות ביוכימיות.
כימיה עילית
בעוד שזנבות השומנים בעיקר מווסתים את התנהגות שלב הדו-שכבתי, היא קבוצת הראש שקובעת את הכימיה של פני השטח שכבתיים. רוב שכבות הדו-שכבות הטבעיות מורכבות בעיקר מ פוספוליפידים, אבל ספינגוליפידים ו סטרולים כמו כולסטרול הם גם מרכיבים חשובים.[24] מבין הפוספוליפידים, קבוצת הראש הנפוצה ביותר היא פוספטידילכולין (PC), המהווה כמחצית מהפוספוליפידים ברוב תאי היונקים.[25] המחשב האישי הוא zwitterionic כיוון שיש לה מטען שלילי על קבוצת הפוספט ומטען חיובי על האמין, מכיוון שמאזן חיובים מקומי זה אינו נטו נטו.
קבוצות ראש אחרות קיימות גם בדרגות שונות ויכולות לכלול פוספטידיל סרין (נ.ב) פוספטידיל אתנולמין (PE) ו- פוספטידיל גליצרול (PG). קבוצות ראש חלופיות אלו מעניקות לרוב פונקציונליות ביולוגית ספציפית שתלויה בהקשר רב. למשל, נוכחות PS על פני הממברנה החוץ תאית של אריתרוציטים הוא סמן של תא אפופטוזיס,[26] ואילו PS ב צלחת צמיחה שלפוחית נחוצה עבור גרעין שֶׁל הידרוקסיפטיט גבישים ומינרליזציה של העצם שלאחר מכן.[27][28] בניגוד למחשבים אישיים, חלק מקבוצות הראש האחרות נושאות מטען נטו, אשר יכול לשנות את האינטראקציות האלקטרוסטטיות של מולקולות קטנות עם שכבת הדו-שכבתית.[29]
תפקידים ביולוגיים
בלימה ונפרדות
התפקיד העיקרי של שכבת הדו-שכבת השומנית בביולוגיה הוא להפריד מֵימִי תאים מסביבתם. בלי צורה כלשהי של מחסום התוחם את "העצמי" מ"לא העצמי ", קשה אפילו להגדיר את המושג אורגניזם או חיים. מחסום זה לובש צורה של שכבה דו שומנית בכל צורות החיים הידועות למעט כמה מינים של ארכיא המשתמשים בשכבה חד-שכבתית של ליפידים.[7] אפילו הוצע כי צורת החיים הראשונה יכולה להיות פשוטה שלפוחית השומנים בדם עם סוליה כמעט ביוסינתטי יכולת להיות ייצור של עוד פוספוליפידים.[30] יכולת החלוקה של שכבת הדו-שכבה השומנית מבוססת על העובדה ש הידרופילי מולקולות אינן יכולות לחצות בקלות את הידרופובי ליבה דו שכבתית, כפי שנדון בתעבורה על פני שכבה דו שכבתית למטה. בגרעין, המיטוכונדריה והכלורופלסטים יש שני שכבות ליפידים, בעוד שמבנים תת-תאיים אחרים מוקפים בשכבה דו-שכבתית אחת (כגון קרום הפלזמה, הרשתית האנדופלזמית, מנגנון גולגי וליזוזומים). לִרְאוֹת אורגנל.[31]
פרוקריוטים יש רק שכבה דו שומנית אחת - קרום תא (ידוע גם בשם קרום הפלזמה). לפרוקריוטים רבים יש גם דופן תא, אך דופן התא מורכבת מ חלבונים או שרשרת ארוכה פחמימות, לא ליפידים. בניגוד, אקריוטים יש מגוון של אברונים כולל ה גַרעִין, מיטוכונדריה, ליזוזומים ו רשתית אנדופלזמית. כל התאים התת-תאיים הללו מוקפים בשכבה דו-שכבתית אחת או יותר ויחד הם בדרך כלל מהווים את רוב השטח הדו-שכבתי הקיים בתא. בכבד הפטוציטים לדוגמא, קרום הפלזמה מהווה רק שני אחוזים מכלל שטח הדו-שכבתי של התא, ואילו הרטיקולום האנדופלזמי מכיל יותר מחמישים אחוז והמיטוכונדריה שלושים אחוז נוספים.[32]
איתות
כנראה הצורה המוכרת ביותר של איתות סלולרי היא שידור סינפטי, לפיה דחף עצבי שהגיע לסופו של אחד עֲצָבוֹן מועבר לנוירון סמוך באמצעות שחרורו של נוירוטרנסמיטרים. שידור זה מתאפשר על ידי פעולתו של שלפוחית סינפטית טעון במוליכים העצביים שישוחררו. שלפוחיות אלה נתיך עם קרום התא בטרמינל הקדם סינפטי ושחרר את תוכנו לחלק החיצוני של התא. לאחר מכן התוכן מתפזר על פני הסינפסה למסוף הפוסט סינפטי.
שכבות דו-שכבתיות בשומנים בדם מעורבות גם בהעברת אותות באמצעות תפקידן כבית חלבוני קרום אינטגרליים. זהו מעמד רחב וחשוב ביותר של ביומולקולה. ההערכה היא כי עד שליש מהאדם פרוטאום הם חלבונים בקרום.[33] חלק מחלבונים אלה קשורים לחלק החיצוני של קרום התא. דוגמה לכך היא ה- CD59 חלבון, שמזהה תאים כ"עצמי "ובכך מעכב את הרסם על ידי מערכת החיסון. ה HIV הנגיף מתחמק מה- מערכת החיסון בין השאר על ידי השתלת חלבונים אלה מהקרום המארח על פני השטח שלו.[32] לחלופין, כמה חלבוני קרום חודרים כל הדרך דרך שכבת הדו-שכבה ומשמשים להעברת אירועי אות בודדים מבחוץ לחלק הפנימי של התא. המעמד הנפוץ ביותר מסוג זה של חלבון הוא קולטן מצויד בחלבון G (GPCR). GPCRs אחראים לחלק ניכר מהיכולת של התא לחוש את סביבתו ובגלל תפקיד חשוב זה, כ- 40% מכלל התרופות המודרניות מכוונות ל- GPCRs.[34]
בנוסף לתהליכים המתווכים על ידי חלבונים ופתרונות, ניתן גם לשכבות דו שומניות להשתתף ישירות באיתות. דוגמה קלאסית לכך היא פוספטידיל סרין -מופעל פגוציטוזיס. בדרך כלל, פוספטידילסרין מופץ באופן סימטרי בקרום התא ונמצא רק בצד הפנימי. במהלך מוות של תאים מתוכנת חלבון הנקרא a scramblase מאזן התפלגות זו, ומציג פוספטידיל סרין על הפנים הדו-שכבתיות החוץ-תאיות. נוכחותו של פוספטידיל סרין מפעילה אז פגוציטוזיס להסרת התא המת או הגוסס.
שיטות אפיון

שכבת הדו-שכבה השומנית היא מבנה קשה מאוד לחקר מכיוון שהוא כה דק ושברירי. למרות מגבלות אלו פותחו עשרות טכניקות במהלך שבעים השנים האחרונות כדי לאפשר חקירות של מבנה ותפקודה.
מדידות חשמל
מדידות חשמליות הן דרך פשוטה לאפיין פונקציה חשובה של שכבה דו שכבתית: יכולתו להתבדל ולמנוע את זרימת היונים בתמיסה. על ידי הפעלת מתח על פני שכבת הדו-שכבה ומדידת הזרם שנוצר, ה- הִתנַגְדוּת של הדו-שכבתי נקבע. התנגדות זו בדרך כלל די גבוהה (108 אוהם-ס"מ2 או יותר) [35] מכיוון שהליבה ההידרופובית אטומה למינים טעונים. נוכחותם של כמה חורים בקנה מידה ננומטר גורמת לעלייה דרמטית בזרם.[36] הרגישות של מערכת זו היא כזו שאפילו פעילות של יחיד תעלות יונים ניתן לפתור.[37]
מיקרוסקופ פלואורסצנטי

מדידות חשמליות אינן מספקות תמונה ממשית כמו הדמיה באמצעות מיקרוסקופ. לא ניתן לראות שכבות דו-שכבתיות במיקרוסקופ מסורתי מכיוון שהן דקות מדי. על מנת לראות שכבות דו-כיווניות, חוקרים משתמשים לעיתים קרובות מיקרוסקופ פלואורסצנטי. מדגם מתרגש באורך גל אחד של אור ונצפה באורך גל שונה, כך שרק מולקולות פלואורסצנטיות עם פרופיל עירור ופליטה תואמים. שכבות דו-שכבתיות טבעיות אינן פלואורסצנטיות, ולכן משתמשים בצבע המתחבר למולקולות הרצויות בשכבה הדו-שכבתית. הרזולוציה מוגבלת בדרך כלל לכמה מאות ננומטר, קטנה בהרבה מתא טיפוסי אך גדולה בהרבה מעובי שכבה דו-שכבתית.
אלקטרון מיקרוסקופי
אלקטרון מיקרוסקופי מציע תמונה ברזולוציה גבוהה יותר. בתוך מיקרוסקופ אלקטרונים, קרן ממוקדת אלקטרונים מתקשר עם הדגימה ולא עם קרן אור כמו במיקרוסקופ מסורתי. בשילוב עם טכניקות הקפאה מהירה, מיקרוסקופ אלקטרונים שימש גם לחקר מנגנוני התחבורה הבין-תאית, למשל כדי להוכיח כי אקסוציטוטי שלפוחית הם אמצעי השחרור הכימי ב סינפסות.[38]
ספקטרוסקופיית תהודה מגנטית גרעינית
31P-ספקטרוסקופיית NMR (תהודה מגנטית גרעינית) נמצא בשימוש נרחב למחקרים של דו שכבות פוספוליפידים וממברנות ביולוגיות בתנאים הילידים. הניתוח[39] שֶׁל 31ספקטרום P-NMR של ליפידים יכול לספק מגוון רחב של מידע אודות אריזה דו שכבתית של שומנים בדם, מעברי פאזה (שלב ג'ל, שלב גביש נוזלי פיזיולוגי, שלבי אדווה, שלבים שאינם דו שכבתיים), כיוון / דינמיקה של קבוצת הראש בשומנים ותכונות אלסטיות של ליפיד טהור. דו שכבתי וכתוצאה מכריכה של חלבונים וביומולקולות אחרות.
מיקרוסקופ כוח אטומי

שיטה חדשה לחקר שכבות שומנים בדם היא מיקרוסקופ כוח אטומי (AFM). במקום להשתמש באלומת אור או חלקיקים, קצה מחודד קטן מאוד סורק את פני השטח על ידי יצירת קשר פיזי עם שכבת הדו-שכבה ועובר על פניו, כמו מחט של נגן תקליטים. AFM היא טכניקה מבטיחה מכיוון שיש בה פוטנציאל תמונה ברזולוציית ננומטר בטמפרטורת החדר ואפילו מתחת למים או חיץ פיזיולוגי, תנאים הנחוצים להתנהגות דו שכבתית טבעית. באמצעות יכולת זו, AFM שימש לבחינת התנהגות דו-שכבתית דינאמית כולל היווצרות נקבוביות (חורים)[40] ומעברי פאזה בשכבות דו-ממדיות נתמכות.[41] יתרון נוסף הוא כי AFM אינו דורש פלואורסצנטי או איזוטופי תיוג של השומנים, מכיוון שקצה החללית מתקשר באופן מכני עם המשטח הדו-שכבתי. מסיבה זו, אותה סריקה יכולה לדמיין גם את הליפידים וגם את החלבונים הקשורים אליהם, לפעמים אפילו ברזולוציה של מולקולה אחת.[40][42] AFM יכול גם לבדוק את האופי המכני של שכבות דו שומניות.[43]
אינטרפרומטריה כפולה של קיטוב
שכבות דו שומניות בשומנים מציגות רמות גבוהות של שבירה משולשת כאשר אינדקס השבירה במישור של שכבת הדו-שכבה שונה מאותו ניצב עד 0.1 מדד שבירה יחידות. זה שימש כדי לאפיין את מידת הסדר וההפרעה בקרב שכבות דו-שכבתיות אינטרפרומטריה כפולה של קיטוב להבין מנגנונים של אינטראקציה בין חלבונים.
חישובים כימיים קוונטיים
שכבות דו שומניות בשומנים הן מערכות מולקולריות מורכבות עם דרגות חופש רבות. לפיכך, סימולציה אטומית של קרום ובפרט ab initio חישובי תכונותיו הם יקרים ויקרים מבחינה חישובית. חישובים כימיים קוונטיים בוצעו לאחרונה בהצלחה להערכה דיפול ו קוואדרופול רגעים של קרומי שומנים בדם.[44]
הובלה על פני שכבה דו-שכבתית
דיפוזיה פסיבית
רוב קוֹטבִי למולקולות יש מסיסות נמוכה ב פַּחמֵימָן ליבה של שכבה דו-שכבתית וכתוצאה מכך יש להם מקדמי חדירות נמוכים על פני שכבת הדו-שכבה. השפעה זו בולטת במיוחד עבור מינים טעונים, בעלי מקדמי חדירות נמוכים אף יותר מאשר מולקולות קוטביות ניטרליות.[45] אניונים בדרך כלל יש שיעור דיפוזיה גבוה יותר דרך שכבות דו-שכבתיות מאשר קטיונים.[46][47] בהשוואה ליונים, למולקולות מים יש למעשה חדירות גדולה יחסית דרך הדו שכבה, כפי שמעידים נפיחות אוסמוטית. כאשר מניחים תא או שלפוחית עם ריכוז מלח פנימי גבוה בתמיסה עם ריכוז מלח נמוך הם יתנפחו ובסופו של דבר יתפוצצו. תוצאה כזו לא תישמר אלא אם כן מים היו מסוגלים לעבור דרך שכבה דו-שכבתית יחסית יחסית. החדירות הגדולה באופן חריג של מים דרך שכבות דו-שכבתיות עדיין לא מובנת לחלוטין וממשיכה להיות נושא לדיון פעיל.[48] מולקולות אפולריות קטנות נטענות מפוזרות דרך שכבות דו שומניות בסדרי גודל רבים מהר יותר מיונים או מים. זה חל גם על שומנים וגם ממסים אורגניים כמו כְּלוֹרוֹפוֹרם ו אֶתֶר. ללא קשר לאופיים הקוטבי שלהם מולקולות גדולות יותר מתפשטות לאט יותר על פני שכבות שומנים בדם מאשר מולקולות קטנות.[49]

משאבות ותעלות יון
שתי מחלקות מיוחדות של חלבון עוסקות במדרונות היוניים שנמצאים על פני ממברנות תאיות ותת-תאיות בטבע- תעלות יונים ו משאבות יונים. גם המשאבות וגם הערוצים הם חלבוני קרום אינטגרליים שעוברים דרך הדו-שכבתי, אבל התפקידים שלהם שונים לגמרי. משאבות יון הן החלבונים הבונים ומתחזקים את המדרגות הכימיות על ידי שימוש במקור אנרגיה חיצוני להנעת יונים כנגד שיפוע הריכוז לאזור גבוה יותר פוטנציאל כימי. מקור האנרגיה יכול להיות ATP, כפי שקורה ל Na+-ק+ ATPase. לחלופין, מקור האנרגיה יכול להיות שיפוע כימי אחר שכבר נמצא במקום, כמו ב- Ca2+/ נא+ נוגד סבלים. באמצעות פעולות משאבות יונים התאים מסוגלים לווסת pH דרך ה- שאיבת פרוטונים.
בניגוד למשאבות יונים, תעלות יונים אינן בונות שיפועים כימיים אלא מפיצות אותם על מנת לבצע עבודה או לשלוח אות. כנראה הדוגמה המוכרת והנלמדת ביותר היא מתח מגודרת Na+ עָרוּץ, המאפשר הולכה של פוטנציאל פעולה לְאוֹרֶך נוירונים. לכל משאבות היונים יש מנגנון טריגר או "שער". בדוגמה הקודמת הייתה זו הטיה חשמלית, אך ניתן להפעיל ערוצים אחרים על ידי קשירת אגוניסט מולקולרי או באמצעות שינוי קונפורמציה בחלבון אחר סמוך.[50]

אנדוציטוזיס ואקסוציטוזיס
יש מולקולות או חלקיקים גדולים מדי או הידרופיליים מכדי לעבור דרך שכבה דו-שכבתית. מולקולות אחרות יכולות לעבור דרך שכבת הדו-שכבתית, אך יש להעבירן במהירות בכמויות כה גדולות עד כי הובלה מסוג ערוץ אינה מעשית. בשני המקרים ניתן להעביר סוגים אלה של מטענים על פני קרום התא דרכו היתוך או ניצני של שלפוחית. כאשר נוצרת שלפוחית בתוך התא ומתמזגת עם קרום הפלזמה כדי לשחרר את תכולתה לחלל החוץ-תאי, תהליך זה מכונה אקסוציטוזיס. בתהליך ההפוך, אזור בקרום התא יתעמק פנימה ובסופו של דבר יצטמצם, ויכלול חלק מהנוזל החוץ-תאי להובלתו לתא. אנדוציטוזה ואקסוציטוזיס מסתמכים על מכונות מולקולריות שונות מאוד לתפקוד, אך שני התהליכים קשורים זה לזה ולא יכולים לעבוד בלעדיהם. המנגנון העיקרי של תלות הדדית זו הוא הכמות הגדולה של חומר השומנים המעורב.[51] בתא טיפוסי, אזור דו שכבתי השווה לכל קרום הפלזמה יעבור במחזור האנדוציטוזיס / האקסוציטוזיס תוך כחצי שעה.[52] אם שני התהליכים הללו לא היו מאזנים זה את זה, התא היה פורח החוצה לגודל בלתי ניתן לניהול או מדלדל לחלוטין את קרום הפלזמה שלו תוך זמן קצר.

אקוציטוזיס בפרוקריוטים: שלפוחית ממברנה אקסוציטוזיס, הידוע בכינויו סחר בשלפוחית הממברנה, תהליך שזכה בפרס נובל (שנה, 2013), נחשב באופן מסורתי לזכות של אוקריוטי תאים.[53] זֶה מִיתוֹס עם זאת היה שבור עם הגילוי כי ננוסקיות, הידוע בכינויו העממי שלפוחית הממברנה החיצונית החיידקית, שפורסם על ידי גרם שלילי חיידקים, מרתקים מולקולות איתות חיידקים לארח או לתאי מטרה[54] לבצע מספר תהליכים לטובת החיידק המפריש, למשל פלישת תאים מארחת[55] ואינטראקציות של חיידקים וסביבה, באופן כללי.[56]
אלקטרופורציה
אלקטרופורציה היא העלייה המהירה בחדירות הדו-שכבתית הנגרמת על ידי יישום שדה חשמלי מלאכותי גדול על פני הממברנה. באופן ניסיוני משתמשים באלקטרופורציה להכנסת מולקולות הידרופיליות לתאים. זוהי טכניקה שימושית במיוחד עבור מולקולות גדולות טעונות כגון DNA, שלעולם לא יתפזר באופן פסיבי על פני הליבה הדו-שכבתית ההידרופובית.[57] בגלל זה, אלקטרופורציה היא אחת משיטות המפתח של transfection כמו גם חיידקים טרנספורמציה. אפילו הוצע כי אלקטרופורציה כתוצאה מ בָּרָק שביתות יכולות להיות מנגנון טבעי העברת גנים אופקית.[58]
עלייה זו בחדירות משפיעה בעיקר על הובלת יונים ומינים מימים אחרים, דבר המצביע על כך שהמנגנון הוא יצירת חורים מלאים במים בקנה מידה בממברנה. למרות אלקטרופורציה ו התמוטטות דיאלקטרית שניהם נובעים מיישום של שדה חשמלי, המנגנונים המעורבים שונים במהותם. בפירוק דיאלקטרי חומר המחסום מיונן ויוצר מסלול מוליך. השינוי החומרי הוא אפוא כימי. לעומת זאת, במהלך אלקטרופורציה המולקולות השומניות אינן משנות כימית אלא פשוט משנות את המיקום, ופותחות נקבובית המשמשת כמסלול המוליך דרך שכבת הדו-שכבה כשהיא מלאה במים.
מֵכָנִיקָה

שכבות דו-שכבתיות בשומנים הן מבנים גדולים מספיק כדי לקבל חלק מהתכונות המכניות של נוזלים או מוצקים. מודול דחיסת השטח Kא, כיפוף כיפוף Kב, ואנרגיית קצה , ניתן להשתמש בהם לתיאורם. לשכבות דו שומניות מוצקות יש גם מודול גזירה, אך כמו כל נוזל, מודול הגזירה הוא אפס עבור שכבות דו-שכבתיות. תכונות מכניות אלו משפיעות על תפקוד הקרום. קא ו- Kב משפיעים על יכולתם של חלבונים ומולקולות קטנות להחדיר לשכבה הדו-שכבתית,[59][60] ותכונות מכניות דו שכבתיות הוכחו כמשנות את תפקודם של תעלות יונים המופעלות מכנית.[61] מאפיינים מכניים דו-שכבתיים שולטים גם באילו סוגי לחץ תא יכול לעמוד בלי לקרוע. למרות ששכבות דו-שכבתיות יכולות להתכופף בקלות, רובן לא יכולות להימתח ביותר מכמה אחוזים לפני קריעה.[62]
כפי שנדון בסעיף מבנה וארגון, המשיכה ההידרופובית של זנבות השומנים במים היא הכוח העיקרי המחזיק שני שכבות שומנים בדם. לפיכך, המודול האלסטי של הדו שכבה נקבע בעיקר על ידי כמה שטח נוסף נחשף למים כאשר מולקולות השומנים נמתחות זו מזו.[63] אין זה מפתיע בהתחשב בהבנה זו של הכוחות המעורבים שמחקרים הראו כי Kא משתנה מאוד עם לחץ אוסמוטי[64] אבל רק בחולשה עם אורך זנב וחוסר רוויה.[10] מכיוון שהכוחות המעורבים הם כה קטנים, קשה לקבוע באופן ניסיוני את Kא. רוב הטכניקות דורשות מיקרוסקופיה מתוחכמת וציוד מדידה רגיש מאוד.[43][65]
בניגוד ל- Kא, המהווה מדד לכמות האנרגיה הדרושה למתיחת שכבת הדו-שכבה, Kב הוא מדד כמה אנרגיה דרושה כדי לכופף או להגמיש את שכבת הדו-שכבה. באופן רשמי, מודול כיפוף מוגדר כאנרגיה הנדרשת לעיוות קרום מהעקמומיות הפנימית שלו לעיקול אחר. עקמומיות פנימית מוגדרת על ידי היחס בין קוטר קבוצת הראש לזה של קבוצת הזנב. עבור שומני מחשב דו-זנבתיים, יחס זה הוא כמעט אחד כך שהעקמומיות הפנימית היא כמעט אפס. אם לשומנים מסוימים סטייה גדולה מדי מאפס עקמומיות פנימית הוא לא יהווה שכבה דו-שכבתית ובמקום זאת ייווצר שלבים אחרים כגון מיסלים או מיסלים הפוכים. תוספת של מולקולות הידרופיליות קטנות כמו סוכרוז לשומנים מעורבים ליפוזומים ממלריים עשוי מממברנות תילאקואידים עשירות בגלקטוליפידים, מערערת את שכבות הדו-שכבות פנימה micellar שלב.[66] בדרך כלל, Kב אינו נמדד בניסוי אלא מחושב על פי מדידות של Kא ועובי דו שכבתי, מכיוון ששלושת הפרמטרים קשורים זה לזה.
הוא מדד כמה אנרגיה נדרשת כדי לחשוף קצה דו שכבתי למים על ידי קריעת הדו שכבה או יצירת חור בו. המקור לאנרגיה זו הוא העובדה שיצירת ממשק כזה חושפת חלק מזנבות השומנים במים, אך הכיוון המדויק של שומני הגבול הללו אינו ידוע. ישנן עדויות לכך שגם נקבוביות הידרופוביות (זנבות ישרות) וגם הידרופיליות (ראשים מעוקלים מסביב) יכולות להתקיים במקביל.[67]
היתוך

היתוך הוא התהליך שבו שני שכבות דו-שכבתיות מתמזגות, וכתוצאה מכך מבנה אחד מחובר. אם היתוך זה מתקיים לחלוטין דרך שני העלונים של שני השכבות הדו-שכבתיות, נוצר גשר מלא מים והפתרונות הכלולים בשכבות הדו-שכבתיות יכולים להתערבב. לחלופין, אם רק עלון אחד מכל שכבה דו-שכבתית מעורב בתהליך ההיתוך, נאמר כי שכבות הדו-שכבתיות מפושטות. היתוך מעורב בתהליכים תאיים רבים, בפרט ב אקריוטים, מכיוון שהתא האוקריוטי מחולק בהרחבה על ידי ממברנות דו שכבתיות בשומנים. אקוציטוזיס, הַפרָיָה של ביצה על ידי הפעלת זרע, והובלת מוצרי פסולת אל ליזוזום הם כמה מן התהליכים האוקריוטים הרבים הנשענים על צורת היתוך כלשהי. אפילו כניסה של פתוגנים יכולה להיות נשלטת על ידי היתוך, כמו רבים שכבתיים מצופים וירוסים יש חלבוני היתוך ייעודיים בכדי לקבל כניסה לתא המארח.
ישנם ארבעה שלבים בסיסיים בתהליך ההיתוך.[25] ראשית, על הממברנות המעורבות להצטבר, להתקרב זו לזו בתוך מספר ננומטרים. שנית, שני הדו שכבתי חייבים לבוא במגע קרוב מאוד (תוך כמה אנגסטרומות). כדי להשיג מגע קרוב זה, שני המשטחים חייבים להתייבש לפחות באופן חלקי, מכיוון שמי השטח הקשורים הנמצאים בדרך כלל גורמים לדחיית שכבות דו-שכבתית. נוכחותם של יונים, ובמיוחד קטיונים דו-ערכיים כמו מגנזיום וסידן, משפיעה מאוד על שלב זה.[68][69] אחד התפקידים הקריטיים של סידן בגוף הוא ויסות היתוך הממברנה. שלישית, נקבע יציבות בשלב שני בין שני שכבות הדו-שכבה, מה שמעוות את מבניהם באופן מקומי. טיבו המדויק של עיוות זה אינו ידוע. תיאוריה אחת היא כי "גבעול" מעוקל מאוד חייב להיווצר בין שני השכבות הדו-שכבתיות.[70] תומכי תיאוריה זו סבורים שהיא מסבירה מדוע פוספטידיל אתנולמין, ליפיד מעוקל מאוד, מקדם היתוך.[71] לבסוף, בשלב האחרון של האיחוי, הליקוי בנקודה זה גדל והרכיבים של שני השכבות הדו-שכבתיות מתערבבים ומתפזרים מאתר המגע.
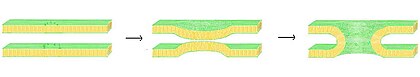

המצב מסובך עוד יותר כאשר שוקלים היתוך in vivo מאז היתוך ביולוגי כמעט תמיד מוסדר על ידי הפעולה של חלבונים הקשורים לקרום. הראשון מחלבונים אלה שנחקרו היו חלבוני היתוך הנגיפיים, המאפשרים מעטפת נגיף כדי להכניס את החומר הגנטי שלו לתא המארח (נגיפים אפופים הם אלה המוקפים בשכבת שומנים בדם; יש אחרים שיש להם מעטה חלבון בלבד). אוקריוטי תאים משתמשים גם בחלבוני היתוך, שנחקרו בצורה הטובה ביותר הם מצחיקים. חלבוני SNARE משמשים לבימוי הכל שַׁלפּוּחִי סחר תוך-תאי. למרות שנים של מחקר, עדיין לא ידוע על תפקוד מחלקת חלבונים זו. למעשה, עדיין קיים ויכוח פעיל בשאלה האם SNARE קשורים לעגינה מוקדמת או משתתפים בהמשך בתהליך ההיתוך על ידי הקלה על המיפוזיה.[73]
במחקרים על ביולוגיה מולקולרית ותאית, לרוב רצוי לגרום להתמזגות מלאכותית. התוספת של פוליאתילן גליקול (PEG) גורם להתמזגות ללא צבירה משמעותית או הפרעה ביוכימית. הליך זה משמש כעת בהרחבה, למשל על ידי פיוזינג תאי B עם מיאלומה תאים.[74] התוצאה "היברידומה ”משילוב זה מבטא רצוי נוֹגְדָן כפי שנקבע על ידי תא B המעורב, אך מונצח עקב רכיב המלנומה. היתוך יכול גם להיגרם באופן מלאכותי באמצעות אלקטרופורציה בתהליך המכונה אלקטרופוזיה. הוא האמין שתופעה זו נובעת מה- קצוות פעילים אנרגטית נוצר במהלך אלקטרופורציה, אשר יכול לשמש כנקודת הפגם המקומית לצמיחת גבעול גרעיני בין שני שכבות דו שכבתיות.[75]
מערכות מודל
ניתן ליצור שכבות דו-שכבתיות באופן מלאכותי במעבדה כדי לאפשר לחוקרים לבצע ניסויים שלא ניתן לעשות עם שכבות טבעיות. הם יכולים לשמש גם בתחום ביולוגיה סינתטית, כדי להגדיר את הגבולות של תאים מלאכותיים. מערכות סינתטיות אלה נקראות שכבות דו-שכבתיות דגם. ישנם סוגים רבים ושונים של שכבות דו-שכבתיות, שלכל אחת מהן יתרונות וחסרונות ניסיוניים. ניתן להכין אותם עם ליפידים סינתטיים או טבעיים. בין מערכות המודל הנפוצות ביותר הן:
- ממברנות ליפידים שחורות (BLM)
- שכבת ליפידים דו-שכבתית נתמכת (SLB)
- ממברנות ליפידים דו-שכבתיות קשורות (t-BLM)
- שלפוחיות
- שכבות ממשק טיפות (DIB)
יישומים מסחריים
עד כה, היישום המסחרי המוצלח ביותר של שכבות דו-שכבתיות בשומנים היה השימוש ב ליפוזומים למשלוח תרופות, במיוחד לטיפול בסרטן. (הערה - המונח "ליפוזום" הוא בעצם שם נרדף ל"שַׁלפּוּחִית "למעט שלפוחית היא מונח כללי למבנה ואילו ליפוזום מתייחס רק לשלפוחיות מלאכותיות ולא טבעיות. הרעיון הבסיסי של מסירת תרופות ליפוזומליות הוא שהתרופה נסתמת בתמיסה בתוך הליפוזום ואז מוזרקת לחולה. These drug-loaded liposomes travel through the system until they bind at the target site and rupture, releasing the drug. In theory, liposomes should make an ideal drug delivery system since they can isolate nearly any hydrophilic drug, can be grafted with molecules to target specific tissues and can be relatively non-toxic since the body possesses biochemical pathways for degrading lipids.[76]
The first generation of drug delivery liposomes had a simple lipid composition and suffered from several limitations. Circulation in the bloodstream was extremely limited due to both שֶׁל הַכְּלָיוֹת clearing and פגוציטוזיס. Refinement of the lipid composition to tune fluidity, surface charge density, and surface hydration resulted in vesicles that adsorb fewer proteins from נַסיוֹב and thus are less readily recognized by the מערכת החיסון.[77] The most significant advance in this area was the grafting of פוליאתילן גליקול (PEG) onto the liposome surface to produce “stealth” vesicles, which circulate over long times without immune or renal clearing.[78]
The first stealth liposomes were passively targeted at גידול סרטני רקמות. Because tumors induce rapid and uncontrolled אנגיוגנזה they are especially “leaky” and allow liposomes to exit the bloodstream at a much higher rate than normal tissue would.[79] יותר לאחרונה[מתי? ] work has been undertaken to graft נוגדנים or other molecular markers onto the liposome surface in the hope of actively binding them to a specific cell or tissue type.[80] Some examples of this approach are already in clinical trials.[81]
Another potential application of lipid bilayers is the field of חיישני ביו. Since the lipid bilayer is the barrier between the interior and exterior of the cell, it is also the site of extensive signal transduction. Researchers over the years have tried to harness this potential to develop a bilayer-based device for clinical diagnosis or bioterrorism detection. Progress has been slow in this area and, although a few companies have developed automated lipid-based detection systems, they are still targeted at the research community. These include Biacore (now GE Healthcare Life Sciences), which offers a disposable chip for utilizing lipid bilayers in studies of binding kinetics[82] and Nanion Inc., which has developed an automated patch clamping מערכת.[83] Other, more exotic applications are also being pursued such as the use of lipid bilayer membrane pores for רצף DNA by Oxford Nanolabs. To date, this technology has not proven commercially viable.
A supported lipid bilayer (SLB) as described above has achieved commercial success as a screening technique to measure the permeability of drugs. זֶה עמ 'arallel אrtificial Membrane עמ 'ermeability אssay PAMPA technique measures the permeability across specifically formulated lipid cocktail(s) found to be highly correlated with קאקו -2 תרבויות,[84][85] ה מערכת עיכול,[86] מחסום דם מוח[87] and skin.[88]
הִיסטוֹרִיָה
By the early twentieth century scientists had come to believe that cells are surrounded by a thin oil-like barrier,[89] but the structural nature of this membrane was not known. Two experiments in 1925 laid the groundwork to fill in this gap. על ידי מדידת ה- קיבול שֶׁל כַּדוּרִית אֲדוּמָה solutions, Hugo Fricke determined that the cell membrane was 3.3 nm thick.[90]
Although the results of this experiment were accurate, Fricke misinterpreted the data to mean that the cell membrane is a single molecular layer. Prof. Dr. Evert Gorter[91] (1881–1954) and F. Grendel of Leiden University approached the problem from a different perspective, spreading the erythrocyte lipids as a monolayer on a שוקת Langmuir-Blodgett. When they compared the area of the monolayer to the surface area of the cells, they found a ratio of two to one.[92] Later analyses showed several errors and incorrect assumptions with this experiment but, serendipitously, these errors canceled out and from this flawed data Gorter and Grendel drew the correct conclusion- that the cell membrane is a lipid bilayer.[25]
This theory was confirmed through the use of אלקטרון מיקרוסקופי בסוף שנות החמישים. Although he did not publish the first electron microscopy study of lipid bilayers[93] J. David Robertson was the first to assert that the two dark electron-dense bands were the headgroups and associated proteins of two apposed lipid monolayers.[94][95] In this body of work, Robertson put forward the concept of the “unit membrane.” This was the first time the bilayer structure had been universally assigned to all cell membranes as well as אברון קרומים.
Around the same time, the development of model membranes confirmed that the lipid bilayer is a stable structure that can exist independent of proteins. By “painting” a solution of lipid in organic solvent across an aperture, Mueller and Rudin were able to create an artificial bilayer and determine that this exhibited lateral fluidity, high electrical resistance and self-healing in response to puncture,[96] all of which are properties of a natural cell membrane. כמה שנים לאחר מכן, Alec Bangham showed that bilayers, in the form of lipid vesicles, could also be formed simply by exposing a dried lipid sample to water.[97] This was an important advance, since it demonstrated that lipid bilayers form spontaneously via self assembly and do not require a patterned support structure.
In 1977, a totally synthetic bilayer membrane was prepared by Kunitake and Okahata, from a single organic compound, didodecyldimethylammonium bromide.[98] It clearly shows that the bilayer membrane was assembled by the אינטראקציה של ואן דר וואלס.
ראה גם
- Category: surfactants
- ביופיזיקה ממברנתית
- פולימורפיזם ליפידים
- ליפידומיקס
הפניות
- ^ Andersen, Olaf S.; Koeppe, II, Roger E. (June 2007). "Bilayer Thickness and Membrane Protein Function: An Energetic Perspective". סקירה שנתית של ביופיזיקה ומבנה ביו-מולקולרי. 36 (1): 107–130. דוי:10.1146/annurev.biophys.36.040306.132643. PMID 17263662.
- ^ Divecha, Nullin; Irvine, Robin F (27 January 1995). "Phospholipid signaling". תָא. 80 (2): 269–278. דוי:10.1016/0092-8674(95)90409-3. PMID 7834746.
- ^ Mashaghi et al. Hydration strongly affects the molecular and electronic structure of membrane phospholipids. 136, 114709 (2012)"The Journal of Chemical Physics". הועבר לארכיון מ המקורי ב -15 במאי 2016. הוחזר 17 במאי 2012.
- ^ א ב Lewis BA, Engelman DM (May 1983). "Lipid bilayer thickness varies linearly with acyl chain length in fluid phosphatidylcholine vesicles". ג'י מול. ביול. 166 (2): 211–7. דוי:10.1016/S0022-2836(83)80007-2. PMID 6854644.
- ^ Zaccai G, Blasie JK, Schoenborn BP (January 1975). "Neutron Diffraction Studies on the Location of Water in Lecithin Bilayer Model Membranes". Proc. נטל Acad. Sci. ארה"ב. 72 (1): 376–380. ביבקוד:1975PNAS...72..376Z. דוי:10.1073/pnas.72.1.376. PMC 432308. PMID 16592215.
- ^ Nagle JF, Tristram-Nagle S (November 2000). "Structure of lipid bilayers". ביוכים. ביופיז. אקטה. 1469 (3): 159–95. דוי:10.1016/S0304-4157(00)00016-2. PMC 2747654. PMID 11063882.
- ^ א ב Parker J, Madigan MT, Brock TD, Martinko JM (2003). Brock biology of microorganisms (מהדורה 10). צוקי אנגלווד, ניו ג'רזי: אולם פרנטיס. ISBN 978-0-13-049147-3.
- ^ Marsh D (July 2001). "פרופילי קוטביות וחלחול בקרומי השומנים בדם". Proc. נטל Acad. Sci. ארה"ב. 98 (14): 7777–82. ביבקוד:2001PNAS ... 98.7777M. דוי:10.1073 / pnas.131023798. PMC 35418. PMID 11438731.
- ^ Marsh D (December 2002). "Membrane water-penetration profiles from spin labels". יור. ביופיז. י. 31 (7): 559–62. דוי:10.1007/s00249-002-0245-z. PMID 12602343.
- ^ א ב ג ד Rawicz W, Olbrich KC, McIntosh T, Needham D, Evans E (July 2000). "Effect of chain length and unsaturation on elasticity of lipid bilayers". ביופיז. י. 79 (1): 328–39. ביבקוד:2000BpJ....79..328R. דוי:10.1016/S0006-3495(00)76295-3. PMC 1300937. PMID 10866959.
- ^ Trauble H, Haynes DH (1971). "The volume change in lipid bilayer lamellae at the crystalline-liquid crystalline phase transition". כימיה. פיז. ליפידים. 7 (4): 324–35. דוי:10.1016/0009-3084(71)90010-7.
- ^ Bretscher MS (1 March 1972). "Asymmetrical Lipid Bilayer Structure for Biological Membranes". טבע ביולוגיה חדשה. 236 (61): 11–12. דוי:10.1038/newbio236011a0. PMID 4502419.
- ^ Verkleij AJ, Zwaal RF, Roelofsen B, Comfurius P, Kastelijn D, van Deenen LL (October 1973). "The asymmetric distribution of phospholipids in the human red cell membrane. A combined study using phospholipases and freeze-etch electron microscopy". ביוכים. ביופיז. אקטה. 323 (2): 178–93. דוי:10.1016/0005-2736(73)90143-0. PMID 4356540.
- ^ Bell RM, Ballas LM, Coleman RA (1 March 1981). "Lipid topogenesis". J. Lipid Res. 22 (3): 391–403. PMID 7017050.
- ^ Bretscher MS (August 1973). "Membrane structure: some general principles". מַדָע. 181 (4100): 622–629. ביבקוד:1973Sci...181..622B. דוי:10.1126/science.181.4100.622. PMID 4724478.
- ^ Rothman JE, Kennedy EP (May 1977). "Rapid transmembrane movement of newly synthesized phospholipids during membrane assembly". Proc. נטל Acad. Sci. ארה"ב. 74 (5): 1821–5. ביבקוד:1977PNAS...74.1821R. דוי:10.1073/pnas.74.5.1821. PMC 431015. PMID 405668.
- ^ Kornberg RD, McConnell HM (March 1971). "Inside-outside transitions of phospholipids in vesicle membranes". בִּיוֹכִימִיָה. 10 (7): 1111–20. דוי:10.1021/bi00783a003. PMID 4324203.
- ^ Litman BJ (July 1974). "Determination of molecular asymmetry in the phosphatidylethanolamine surface distribution in mixed phospholipid vesicles". בִּיוֹכִימִיָה. 13 (14): 2844–8. דוי:10.1021/bi00711a010. PMID 4407872.
- ^ Crane JM, Kiessling V, Tamm LK (February 2005). "Measuring lipid asymmetry in planar supported bilayers by fluorescence interference contrast microscopy". לנגמויר. 21 (4): 1377–88. דוי:10.1021/la047654w. PMID 15697284.
- ^ Kalb E, Frey S, Tamm LK (January 1992). "Formation of supported planar bilayers by fusion of vesicles to supported phospholipid monolayers". ביוכים. ביופיז. אקטה. 1103 (2): 307–16. דוי:10.1016/0005-2736(92)90101-Q. PMID 1311950.
- ^ Lin WC, Blanchette CD, Ratto TV, Longo ML (January 2006). "Lipid asymmetry in DLPC/DSPC-supported lipid bilayers: a combined AFM and fluorescence microscopy study". ביופיז. י. 90 (1): 228–37. ביבקוד:2006BpJ .... 90..228L. דוי:10.1529 / biophysj.105.067066. PMC 1367021. PMID 16214871.
- ^ Berg, Howard C. (1993). Random walks in biology (Extended Paperback ed.). פרינסטון, ניו ג'רזי: הוצאת אוניברסיטת פרינסטון. ISBN 978-0-691-00064-0.
- ^ Dietrich C, Volovyk ZN, Levi M, Thompson NL, Jacobson K (September 2001). "חלוקה של אנלוגים פוספוליפידים Thy-1, GM1 ומוצלבים לרפסודות שומנים שהורכבו בשכבות קרום מודליות נתמכות". Proc. נטל Acad. Sci. ארה"ב. 98 (19): 10642–7. ביבקוד:2001PNAS...9810642D. דוי:10.1073 / pnas.191168698. PMC 58519. PMID 11535814.
- ^ Alberts, Bruce (2017). "Chapter 10: Membrane Structures". ביולוגיה מולקולרית של התא. מדע גרלנד. ISBN 9781317563747.
- ^ א ב ג Yeagle, Philip (1993). קרומי התאים (מהדורה שנייה). בוסטון: עיתונות אקדמית. ISBN 978-0-12-769041-4.
- ^ Fadok VA, Bratton DL, Frasch SC, Warner ML, Henson PM (July 1998). "The role of phosphatidylserine in recognition of apoptotic cells by phagocytes". מוות של תאים שונה. 5 (7): 551–62. דוי:10.1038/sj.cdd.4400404. PMID 10200509.
- ^ Anderson HC, Garimella R, Tague SE (January 2005). "The role of matrix vesicles in growth plate development and biomineralization". חֲזִית. ביוסקי. 10 (1–3): 822–37. דוי:10.2741/1576. PMID 15569622.
- ^ Eanes ED, Hailer AW (January 1987). "Calcium phosphate precipitation in aqueous suspensions of phosphatidylserine-containing anionic liposomes". Calcif. Tissue Int. 40 (1): 43–8. דוי:10.1007/BF02555727. PMID 3103899.
- ^ Kim J, Mosior M, Chung LA, Wu H, McLaughlin S (July 1991). "Binding of peptides with basic residues to membranes containing acidic phospholipids". ביופיז. י. 60 (1): 135–48. ביבקוד:1991BpJ....60..135K. דוי:10.1016/S0006-3495(91)82037-9. PMC 1260045. PMID 1883932.
- ^ Koch AL (1984). "Primeval cells: possible energy-generating and cell-division mechanisms". ג'י מול. Evol. 21 (3): 270–7. ביבקוד:1985JMolE..21..270K. דוי:10.1007/BF02102359. PMID 6242168.
- ^ "5.1 Cell Membrane Structure | Life Science | University of Tokyo". הועבר לארכיון מ המקורי ב- 22 בפברואר 2014. הוחזר 10 בנובמבר 2012.
- ^ א ב אלברטס, ברוס (2002). ביולוגיה מולקולרית של התא (מהדורה רביעית). ניו יורק: גרלנד מדע. ISBN 978-0-8153-4072-0.
- ^ Martelli PL, Fariselli P, Casadio R (2003). "An ENSEMBLE machine learning approach for the prediction of all-alpha membrane proteins". ביואינפורמטיקה. 19 (Suppl 1): i205–11. דוי:10.1093/bioinformatics/btg1027. PMID 12855459.
- ^ Filmore D (2004). "It's A GPCR World". גילוי סמים מודרני. 11: 24–9.
- ^ Montal M, Mueller P (December 1972). "Formation of bimolecular membranes from lipid monolayers and a study of their electrical properties". Proc. נטל Acad. Sci. 69 (12): 3561–6. ביבקוד:1972PNAS...69.3561M. דוי:10.1073/pnas.69.12.3561. PMC 389821. PMID 4509315.
- ^ Melikov KC, Frolov VA, Shcherbakov A, Samsonov AV, Chizmadzhev YA, Chernomordik LV (April 2001). "Voltage-induced nonconductive pre-pores and metastable single pores in unmodified planar lipid bilayer". ביופיז. י. 80 (4): 1829–36. ביבקוד:2001BpJ....80.1829M. דוי:10.1016/S0006-3495(01)76153-X. PMC 1301372. PMID 11259296.
- ^ Neher E, Sakmann B (April 1976). "Single-channel currents recorded from membrane of denervated frog muscle fibres". טֶבַע. 260 (5554): 799–802. ביבקוד:1976Natur.260..799N. דוי:10.1038/260799a0. PMID 1083489.
- ^ Heuser JE, Reese TS, Dennis MJ, Jan Y, Jan L, Evans L (May 1979). "Synaptic vesicle exocytosis captured by quick freezing and correlated with quantal transmitter release". ג'י ביול. 81 (2): 275–300. דוי:10.1083/jcb.81.2.275. PMC 2110310. PMID 38256.
- ^ Dubinnyi MA, Lesovoy DM, Dubovskii PV, Chupin VV, Arseniev AS (June 2006). "Modeling of 31P-NMR spectra of magnetically oriented phospholipid liposomes: A new analytical solution". Solid State Nucl Magn Reson. 29 (4): 305–311. דוי:10.1016/j.ssnmr.2005.10.009. PMID 16298110.[קישור מת ]
- ^ א ב ג Roiter, Yuri; Ornatska, Maryna; Rammohan, Aravind R.; Balakrishnan, Jitendra; Heine, David R.; Minko, Sergiy (2008). "אינטראקציה של חלקיקי ננו עם קרום ליפיד". אותיות ננו. 8 (3): 941–944. ביבקוד:2008 NanoL ... 8..941R. דוי:10.1021 / nl080080l. PMID 18254602.
- ^ Tokumasu F, Jin AJ, Dvorak JA (2002). "Lipid membrane phase behavior elucidated in real time by controlled environment atomic force microscopy". J. Electron Micros. 51 (1): 1–9. דוי:10.1093/jmicro/51.1.1. PMID 12003236.
- ^ Richter RP, Brisson A (2003). "Characterization of lipid bilayers and protein assemblies supported on rough surfaces by atomic force microscopy". לנגמויר. 19 (5): 1632–40. דוי:10.1021/la026427w.
- ^ א ב Steltenkamp S, Müller MM, Deserno M, Hennesthal C, Steinem C, Janshoff A (July 2006). "תכונות מכניות של דו שכבות שומנים המשתרעות על נקבוביות ונבדקות במיקרוסקופ כוח אטומי". ביופיז. י. 91 (1): 217–26. ביבקוד:2006BpJ .... 91..217S. דוי:10.1529 / biophysj.106.081398. PMC 1479081. PMID 16617084.
- ^ Alireza Mashaghi et al., Hydration strongly affects the molecular and electronic structure of membrane phospholipids. J. Chem. פיז. 136, 114709 (2012) "The Journal of Chemical Physics". הועבר לארכיון מ המקורי ב -15 במאי 2016. הוחזר 17 במאי 2012.
- ^ Chakrabarti AC (1994). "Permeability of membranes to amino acids and modified amino acids: mechanisms involved in translocation". חומצות אמינו. 6 (3): 213–29. דוי:10.1007/BF00813743. PMID 11543596.
- ^ Hauser H, Phillips MC, Stubbs M (October 1972). "Ion permeability of phospholipid bilayers". טֶבַע. 239 (5371): 342–4. ביבקוד:1972Natur.239..342H. דוי:10.1038/239342a0. PMID 12635233.
- ^ Papahadjopoulos D, Watkins JC (September 1967). "Phospholipid model membranes. II. Permeability properties of hydrated liquid crystals". ביוכים. ביופיז. אקטה. 135 (4): 639–52. דוי:10.1016/0005-2736(67)90095-8. PMID 6048247.
- ^ Paula S, Volkov AG, Van Hoek AN, Haines TH, Deamer DW (January 1996). "Permeation of protons, potassium ions, and small polar molecules through phospholipid bilayers as a function of membrane thickness". ביופיז. י. 70 (1): 339–48. ביבקוד:1996BpJ....70..339P. דוי:10.1016/S0006-3495(96)79575-9. PMC 1224932. PMID 8770210.
- ^ Xiang TX, Anderson BD (June 1994). "The relationship between permeant size and permeability in lipid bilayer membranes". ג'יי ממבר. ביול. 140 (2): 111–22. דוי:10.1007/bf00232899. PMID 7932645.
- ^ Gouaux E, Mackinnon R (December 2005). "Principles of selective ion transport in channels and pumps". מַדָע. 310 (5753): 1461–5. ביבקוד:2005Sci...310.1461G. דוי:10.1126/science.1113666. PMID 16322449.
- ^ Gundelfinger ED, Kessels MM, Qualmann B (February 2003). "Temporal and spatial coordination of exocytosis and endocytosis". נט. הכומר מול. תאי ביול. 4 (2): 127–39. דוי:10.1038/nrm1016. PMID 12563290.
- ^ Steinman RM, Brodie SE, Cohn ZA (March 1976). "Membrane flow during pinocytosis. A stereologic analysis". ג'י ביול. 68 (3): 665–87. דוי:10.1083/jcb.68.3.665. PMC 2109655. PMID 1030706.
- ^ ישרוי ר.צ. (1999) 'Exocytosis in prokaryotes' and its role in סלמונלה פְּלִישָׁה. ICAR NEWS - A Science and Technology Newsletter, (Oct-Dec) vol. 5(4), page 18.https://www.researchgate.net/publication/230822402_'Exocytosis_in_prokaryotes'_and_its_role_in_Salmonella_invasion?ev=prf_pub
- ^ YashRoy R C (1993) Electron microscope studies of surface pili and vesicles of סלמונלה 3,10:r:- organisms. Ind Jl of Anim Sci 63, 99-102.https://www.researchgate.net/publication/230817087_Electron_microscope_studies_of_surface_pilli_and_vesicles_of_Salmonella_310r-_organisms?ev=prf_pub
- ^ ישרוי ר.צ. (1998) Discovery of vesicular exocytosis in prokaryotes and its role in סלמונלה פְּלִישָׁה. מדע עכשווי, כרך 75(10), pp. 1062-1066.https://www.researchgate.net/publication/230793568_Discovery_of_vesicular_exocytosis_in_prokaryotes_and_its_role_in_Salmonella_invasion?ev=prf_pub
- ^ YashRoy RC (1998). "Exocytosis from gram negative bacteria for סלמונלה invasion of chicken ileal epithelium". Indian Journal of Poultry Science. 33 (2): 119–123.
- ^ נוימן E, Schaefer-Ridder M, Wang Y, Hofschneider PH (1982). "העברת גנים לתאי ליומה של עכבר באמצעות אלקטרופורציה בשדות חשמליים גבוהים". EMBO J. 1 (7): 841–5. דוי:10.1002 / j.1460-2075.1982.tb01257.x. PMC 553119. PMID 6329708.
- ^ Demanèche S, Bertolla F, Buret F, et al. (אוגוסט 2001). "עדויות בקנה מידה מעבדה להעברת גנים בתיווך בקרקע". אפליקציה סביבה. מיקרוביול. 67 (8): 3440–4. דוי:10.1128 / AEM.67.8.3440-3444.2001. PMC 93040. PMID 11472916.
- ^ Garcia ML (July 2004). "Ion channels: gate expectations". טֶבַע. 430 (6996): 153–5. ביבקוד:2004Natur.430..153G. דוי:10.1038/430153a. PMID 15241399.
- ^ McIntosh TJ, Simon SA (2006). "Roles of Bilayer Material Properties in Function and Distribution of Membrane Proteins". אננו. הכומר ביופיס. ביומול. מבנה. 35 (1): 177–98. דוי:10.1146/annurev.biophys.35.040405.102022. PMID 16689633.
- ^ Suchyna TM, Tape SE, Koeppe RE, Andersen OS, Sachs F, Gottlieb PA (July 2004). "Bilayer-dependent inhibition of mechanosensitive channels by neuroactive peptide enantiomers". טֶבַע. 430 (6996): 235–40. ביבקוד:2004Natur.430..235S. דוי:10.1038/nature02743. PMID 15241420.
- ^ Hallett FR, Marsh J, Nickel BG, Wood JM (February 1993). "Mechanical properties of vesicles. II. A model for osmotic swelling and lysis". ביופיז. י. 64 (2): 435–42. ביבקוד:1993BpJ....64..435H. דוי:10.1016/S0006-3495(93)81384-5. PMC 1262346. PMID 8457669.
- ^ Boal, David H. (2001). Mechanics of the cell. קיימברידג ', בריטניה: הוצאת אוניברסיטת קיימברידג'. ISBN 978-0-521-79681-1.
- ^ Rutkowski CA, Williams LM, Haines TH, Cummins HZ (June 1991). "The elasticity of synthetic phospholipid vesicles obtained by photon correlation spectroscopy". בִּיוֹכִימִיָה. 30 (23): 5688–96. דוי:10.1021/bi00237a008. PMID 2043611.
- ^ Evans E, Heinrich V, Ludwig F, Rawicz W (October 2003). "Dynamic tension spectroscopy and strength of biomembranes". ביופיז. י. 85 (4): 2342–50. ביבקוד:2003BpJ....85.2342E. דוי:10.1016/S0006-3495(03)74658-X. PMC 1303459. PMID 14507698.
- ^ ישרוי ר.צ. (1994) Destabilisation of lamellar dispersion of תילקואיד membrane lipids by sucrose. Biochimica et Biophysica Acta, כרך 1212, pp. 129-133.https://www.researchgate.net/publication/15042978_Destabilisation_of_lamellar_dispersion_of_thylakoid_membrane_lipids_by_sucrose?ev=prf_pub
- ^ Weaver JC, Chizmadzhev YA (1996). "Theory of electroporation: A review". Biochemistry and Bioenergetics. 41 (2): 135–60. דוי:10.1016/S0302-4598(96)05062-3.
- ^ Papahadjopoulos D, Nir S, Düzgünes N (אפריל 1990). "Molecular mechanisms of calcium-induced membrane fusion". ג'יי ביואנרג. Biomembr. 22 (2): 157–79. דוי:10.1007/BF00762944. PMID 2139437.
- ^ Leventis R, Gagné J, Fuller N, Rand RP, Silvius JR (November 1986). "Divalent cation induced fusion and lipid lateral segregation in phosphatidylcholine-phosphatidic acid vesicles". בִּיוֹכִימִיָה. 25 (22): 6978–87. דוי:10.1021/bi00370a600. PMID 3801406.
- ^ Markin VS, Kozlov MM, Borovjagin VL (October 1984). "On the theory of membrane fusion. The stalk mechanism". Gen. Physiol. ביופיז. 3 (5): 361–77. PMID 6510702.
- ^ Chernomordik LV, Kozlov MM (2003). "Protein-lipid interplay in fusion and fission of biological membranes". אננו. הכומר ביוכם. 72 (1): 175–207. דוי:10.1146/annurev.biochem.72.121801.161504. PMID 14527322.
- ^ Georgiev, Danko D.; Glazebrook, James F. (2007). "Subneuronal processing of information by solitary waves and stochastic processes". In Lyshevski, Sergey Edward (ed.). מדריך ננו ואלקטרוניקה מולקולרית. Nano and Microengineering Series. עיתונות CRC. עמ.17 –1–17–41. דוי:10.1201/9781315221670-17. ISBN 978-0-8493-8528-5.
- ^ Chen YA, Scheller RH (February 2001). "SNARE-mediated membrane fusion". נט. הכומר מול. תאי ביול. 2 (2): 98–106. דוי:10.1038/35052017. PMID 11252968.
- ^ Köhler G, Milstein C (August 1975). "Continuous cultures of fused cells secreting antibody of predefined specificity". טֶבַע. 256 (5517): 495–7. ביבקוד:1975Natur.256..495K. דוי:10.1038/256495a0. PMID 1172191.
- ^ Jordan, Carol A.; Neumann, Eberhard; Sowershi mason, Arthur E. (1989). Electroporation and electrofusion in cell biology. ניו יורק: הוצאת מליאה. ISBN 978-0-306-43043-5.
- ^ Immordino ML, Dosio F, Cattel L (2006). "Stealth liposomes: review of the basic science, rationale, and clinical applications, existing and potential". Int J Nanomed. 1 (3): 297–315. דוי:10.2217/17435889.1.3.297. PMC 2426795. PMID 17717971.
- ^ Chonn A, Semple SC, Cullis PR (15 September 1992). "Association of blood proteins with large unilamellar liposomes in vivo. Relation to circulation lifetimes". ג'יי ביול. כימיה. 267 (26): 18759–65. PMID 1527006.
- ^ Boris EH, Winterhalter M, Frederik PM, Vallner JJ, Lasic DD (1997). "Stealth liposomes: from theory to product". ביקורות מתקדמות על מתן תרופות. 24 (2–3): 165–77. דוי:10.1016/S0169-409X(96)00456-5.
- ^ Maeda H, Sawa T, Konno T (July 2001). "Mechanism of tumor-targeted delivery of macromolecular drugs, including the EPR effect in solid tumor and clinical overview of the prototype polymeric drug SMANCS". שחרור בקרה. 74 (1–3): 47–61. דוי:10.1016/S0168-3659(01)00309-1. PMID 11489482.
- ^ Lopes DE, Menezes DE, Kirchmeier MJ, Gagne JF (1999). "Cellular trafficking and cytotoxicity of anti-CD19-targeted liposomal doxorubicin in B lymphoma cells". Journal of Liposome Research. 9 (2): 199–228. דוי:10.3109/08982109909024786.
- ^ Matsumura Y, Gotoh M, Muro K, et al. (מרץ 2004). "Phase I and pharmacokinetic study of MCC-465, a doxorubicin (DXR) encapsulated in PEG immunoliposome, in patients with metastatic stomach cancer". אן. אונקול. 15 (3): 517–25. דוי:10.1093/annonc/mdh092. PMID 14998859.
- ^ [1]. Biacore Inc. Retrieved Feb 12, 2009.
- ^ Nanion Technologies. Automated Patch Clamp. Retrieved Feb 28, 2010. (PDF)
- ^ Bermejo, M.; Avdeef, A.; Ruiz, A.; Nalda, R.; Ruell, J. A.; Tsinman, O.; González, I.; Fernández, C.; Sánchez, G.; Garrigues, T. M.; Merino, V. (2004). "PAMPA--a drug absorption in vitro model 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones". כתב העת האירופי למדעי התרופות. 21 (4): 429–41. דוי:10.1016/j.ejps.2003.10.009. PMID 14998573.
- ^ Avdeef, A.; Artursson, P.; Neuhoff, S.; Lazorova, L.; Gråsjö, J.; Tavelin, S. (2005). "Caco-2 permeability of weakly basic drugs predicted with the double-sink PAMPA pKa(flux) method". כתב העת האירופי למדעי התרופות. 24 (4): 333–49. דוי:10.1016/j.ejps.2004.11.011. PMID 15734300.
- ^ Avdeef, A.; Nielsen, P. E.; Tsinman, O. (2004). "PAMPA--a drug absorption in vitro model 11. Matching the in vivo unstirred water layer thickness by individual-well stirring in microtitre plates". כתב העת האירופי למדעי התרופות. 22 (5): 365–74. דוי:10.1016/j.ejps.2004.04.009. PMID 15265506.
- ^ Dagenais, C.; Avdeef, A.; Tsinman, O.; Dudley, A.; Beliveau, R. (2009). "P-glycoprotein deficient mouse in situ blood-brain barrier permeability and its prediction using an in combo PAMPA model". כתב העת האירופי למדעי התרופות. 38 (2): 121–37. דוי:10.1016/j.ejps.2009.06.009. PMC 2747801. PMID 19591928.
- ^ Sinkó, B.; Kökösi, J.; Avdeef, A.; Takács-Novák, K. (2009). "A PAMPA study of the permeability-enhancing effect of new ceramide analogues". כימיה ומגוון ביולוגי. 6 (11): 1867–74. דוי:10.1002/cbdv.200900149. PMID 19937821.
- ^ Loeb J (December 1904). "The recent development of Biology". מַדָע. 20 (519): 777–786. ביבקוד:1904Sci....20..777L. דוי:10.1126/science.20.519.777. PMID 17730464.
- ^ Fricke H (1925). "The electrical capacity of suspensions with special reference to blood". כתב העת לפיזיולוגיה כללית. 9 (2): 137–52. דוי:10.1085/jgp.9.2.137. PMC 2140799. PMID 19872238.
- ^ Dooren LJ, Wiedemann LR (1986). "On bimolecular layers of lipids on the chromocytes of the blood". Journal of European Journal of Pediatrics. 145 (5): 329. דוי:10.1007/BF00439232. PMID 3539619.
- ^ Gorter E, Grendel F (1925). "On bimolecular layers of lipids on the chromocytes of the blood". כתב העת לרפואה ניסיונית. 41 (4): 439–43. דוי:10.1084 / jem.41.4.439. PMC 2130960. PMID 19868999.
- ^ Sjöstrand FS, Andersson-Cedergren E, Dewey MM (April 1958). "The ultrastructure of the intercalated discs of frog, mouse and guinea pig cardiac muscle". J. Ultrastruct. מילואים. 1 (3): 271–87. דוי:10.1016/S0022-5320(58)80008-8. PMID 13550367.
- ^ Robertson JD (1960). "The molecular structure and contact relationships of cell membranes". פרוג. ביופיז. מול. ביול. 10: 343–418. PMID 13742209.
- ^ Robertson JD (1959). "התשתית האולטרא-סטרטית של קרומי התאים ונגזרותיהן". ביוכם. Soc. סימפ. 16: 3–43. PMID 13651159.
- ^ Mueller P, Rudin DO, Tien HT, Wescott WC (June 1962). "הכנה מחדש של מבנה קרום התא במבחנה והפיכתו למערכת נלהבת". טֶבַע. 194 (4832): 979–80. ביבקוד:1962 Natur.194..979 מ '. דוי:10.1038 / 194979a0. PMID 14476933.
- ^ Bangham, A. D.; Horne, R. W. (1964). "Negative Staining of Phospholipids and Their Structural Modification by Surface-Active Agents As Observed in the Electron Microscope". כתב העת לביולוגיה מולקולרית. 8 (5): 660–668. דוי:10.1016/S0022-2836(64)80115-7. PMID 14187392.
- ^ Kunitake T (1977). "A totally synthetic bilayer membrane". ריבה. כימיה. Soc. 99 (11): 3860–3861. דוי:10.1021/ja00453a066.
קישורים חיצוניים
- Avanti Lipids One of the largest commercial suppliers of lipids. Technical information on lipid properties and handling and lipid bilayer preparation techniques.
- LIPIDAT An extensive database of lipid physical properties
- Structure of Fluid Lipid Bilayers Simulations and publication links related to the cross sectional structure of lipid bilayers.
- Lipid Bilayers and the Gramicidin Channel (requires Java plugin) Pictures and movies showing the results of molecular dynamics simulations of lipid bilayers.
- Structure of Fluid Lipid Bilayers, from the Stephen White laboratory at אוניברסיטת קליפורניה, אירווין
- Animations of lipid bilayer dynamics (requires Flash plugin)



