חומצות אמינו הם תרכובות אורגניות המכילים אמין (–NH2) ו קרבוקסיל (–COOH) קבוצות פונקציונליות, יחד עם א שרשרת צד (קבוצת R) ספציפית לכל חומצת אמינו.[1][2] המפתח אלמנטים של חומצת אמינו הם פַּחמָן (ג), מֵימָן (H), חַמצָן (O), ו חַנקָן (N), אם כי יסודות אחרים נמצאים בשרשראות הצד של חומצות אמינו מסוימות. ידועים כ -500 חומצות אמינו באופן טבעי (אם כי רק 20 מופיעות באזור קוד גנטי ) וניתן לסווג אותם בדרכים רבות.[3] ניתן לסווג אותם בהתאם למיקומי הליבה של קבוצות פונקציונליות מבניות כ- אלפא- (α-), בטא- (β-), גמא- (γ-) או דלתא- (δ-) חומצות אמינו; קטגוריות אחרות מתייחסות ל קוטביות, pH סוג וקבוצת שרשרת צדדית (אליפטי, מחזורי, אֲרוֹמָתִי, המכיל הידרוקסיל אוֹ גוֹפרִית, וכו.). בצורה של חלבונים, חומצת אמינו שאריות מהווים את הרכיב השני בגודלו (מים הוא האדם הגדול ביותר) שרירים ואחר רקמות.[4] מעבר לתפקידם כשאריות בחלבונים, חומצות אמינו משתתפות במספר תהליכים כגון נוירוטרנסמיטר הובלה ו ביוסינתזה.
ב בִּיוֹכִימִיָה, חומצות אמינו שקבוצת האמין קשורה ל (אלפא) פחמן לאטום לצד קבוצת הקרבוקסיל יש חשיבות מיוחדת. הם ידועים בשם 2-, אלפא-, או חומצות אמינו (גנרית נוּסחָה ה2NCHRCOOH ברוב המקרים,[א] איפה R הוא אורגני מתמיר מכונה "שרשרת צד ");[5] לעתים קרובות המונח "חומצת אמינו" משמש להתייחסות ספציפית לאלה. הם כוללים את 22 חלבון ("בונה חלבון") חומצות אמינו,[6][7][8] שמשלבים לתוך פפטיד שרשראות ("פוליפפטידים") ליצירת אבני הבניין של מגוון עצום של חלבונים.[9] כל אלה ל-סטריאוייזומרים ("שמאלי " איזומרים ), אם כי כמה דחומצות אמינו ("ימנית") מתרחשות ב מעטפות חיידקיות, כ נוירומודולטור (ד-סרין ), ובחלקם אַנְטִיבִּיוֹטִיקָה.[10]
עשרים מחומצות האמינו החלבוניות מקודדות ישירות על ידי שלישיות קודונים בתוך ה קוד גנטי והן ידועות כחומצות אמיניות "סטנדרטיות". שני האחרים ("לא תקני" או "לא קנוני") הם סלנוציסטאין (נוכח ברבים פרוקריוטים כמו גם רוב אקריוטים, אך לא מקודד ישירות על ידי DNA ), ו פירוליזין (נמצא רק בחלק ארכאה ואחד חיידק ). פירוליזין וסלנוציסטאין מקודדים באמצעות קודונים משתנים; למשל, סלנוציסטאין מקודד על ידי עצור קודון ו אלמנט SECIS.[11][12][13] נ-פורמילתיונין (שהיא לעיתים קרובות חומצת אמינו ראשונית של חלבונים בחיידקים, מיטוכונדריה, ו כלורופלסטים ) נחשב בדרך כלל כצורה של מתיונין ולא כחומצת אמינו נפרדת. קודון–tRNA ניתן להשתמש גם בשילובים שלא נמצאים בטבע "להרחיב" את הקוד הגנטי ויוצרים חלבונים חדשים המכונים אלופרוטאינים שילוב חומצות אמינו שאינן חלבוניות.[14][15][16]
לחומצות אמיניות רבות וחלבוניות חשובות ולא חלבוניות יש פונקציות ביולוגיות. לדוגמא, ב מוח אנושי, גלוטמט (סטנדרטי חומצה גלוטמית ) ו חומצה גמא-אמינו-בוטירית ("גאבא", חומצת גמא-אמינו לא תקנית) הם, בהתאמה, העיקריים נוירוטרנסמיטרים מעוררים ומעכבים.[17] הידרוקספרולין, מרכיב עיקרי של רקמת חיבור קולגן, מסונתז מ פרולין. גליצין הוא מבשר ביוסינתטי ל- פורפירינים משמש ב תאי דם אדומים. קרניטין משמש ב הובלת שומנים בדם. תשע חומצות אמינו חלבוניות נקראות "חִיוּנִי "לבני אדם מכיוון שלא ניתן לייצר אותם מאחרים תרכובות על ידי גוף האדם ולכן יש לקחת אותו כמזון. אחרים עשויים להיות חיוני מותנה לגילאים מסוימים או מצבים רפואיים. חומצות אמינו חיוניות עשויות גם להיות שונות זו מזו מִין.[b] בגלל חשיבותם הביולוגית, חומצות אמינו חשובות בתזונה והן משמשות בדרך כלל ב תוספים תזונתיים, דשנים, הזנה, ו טכנולוגיית מזון. השימושים התעשייתיים כוללים ייצור של סמים, פלסטיק מתכלה, ו זרזים כיראליים.
הִיסטוֹרִיָה
חומצות האמינו הראשונות התגלו בתחילת המאה ה -19.[18][19] בשנת 1806, כימאים צרפתים לואי-ניקולה ווקלין ו פייר ז'אן רוביקט בודד תרכובת ב אספרגוס לאחר מכן נקרא שם אספרגין, חומצת האמינו הראשונה שהתגלתה.[20][21] ציסטין התגלה בשנת 1810,[22] למרות שהמונומר שלו, ציסטאין, נותרה ללא גילוי עד 1884.[21][23] גליצין ו לאוצין התגלו בשנת 1820.[24] האחרונה מבין 20 חומצות האמינו הנפוצות שהתגלו הייתה תראונין בשנת 1935 על ידי ויליאם קאמינג רוז, שקבע גם את חומצות אמינו חיוניות וקבע את הדרישות המינימליות היומיות של כל חומצות האמינו לצמיחה מיטבית.[25][26]
אחדות הקטגוריה הכימית הוכרה על ידי וורץ בשנת 1865, אך הוא לא נתן לזה שום שם מיוחד.[27] השימוש הראשון במונח "חומצת אמינו" בשפה האנגלית הוא משנת 1898,[28] ואילו המונח הגרמני, Aminosäure, נעשה שימוש קודם לכן.[29] נמצא כי חלבונים מניבים חומצות אמינו לאחר עיכול אנזימטי או חומצה הִידרוֹלִיזָה. בשנת 1902, אמיל פישר ו פרנץ הופמייסטר הציע באופן עצמאי כי חלבונים נוצרים מחומצות אמיניות רבות, לפיה נוצרים קשרים בין קבוצת האמינו של חומצת אמינו אחת לקבוצת הקרבוקסיל של אחרת, וכתוצאה מכך נוצר מבנה ליניארי שפישר כינה "פפטיד ".[30]
מבנה כללי
במבנה המוצג בראש הדף, ר מייצג א שרשרת צד ספציפית לכל חומצת אמינו. ה פַּחמָן אטום ליד קבוצת קרבוקסיל נקרא α – פחמן. חומצות אמינו המכילות קבוצת אמינו הנקשרים ישירות לפחמן האלפא מכונים חומצות אמינו אלפא.[31] אלה כוללים חומצות אמינו כגון פרולין המכילים אמינים משניים, שפעם התייחסו אליו לעתים קרובות כ"חומצות אימינו ".[32][33][34]
איזומריזם
חומצות אמינו אלפא הן הצורה הנפוצה ביותר המצויה בטבע, אך רק כאשר הן מתרחשות ב ל-איזומר. פחמן האלפא הוא a כיראלי אטום פחמן, למעט גליצין, שיש לו שני אטומי מימן שאינם ניתנים להבחנה על פחמן האלפא.[35] לכן, כל חומצות האמינו אלפא אבל גליצין יכול להתקיים באחד משניים אננטיומרים, שקוראים לו ל אוֹ ד חומצות אמינו (תצורה יחסית), שהם תמונות מראה זה לזה (ראה גם כיראליות ). בזמן לחומצות אמינו מייצגות את כל חומצות האמינו המצויות ב חלבונים במהלך התרגום בריבוזום, דחומצות אמינו נמצאות בכמה חלבונים המיוצרים על ידי אנזים לאחר תִרגוּם והובלה אל רשתית אנדופלזמית, כמו באורגניזמים השוכנים בים אקזוטיים כגון חלזונות חרוט.[36] הם גם מרכיבים בשפע של פפטידוגליקן קירות התא של חיידקים,[37] ו ד-סריין עשוי לשמש כ- נוירוטרנסמיטר במוח.[38] דחומצות אמינו משמשות ב קריסטלוגרפיה גזענית ליצור גבישים צנטר-סימטריים, אשר (תלוי בחלבון) עשויים לאפשר קביעת מבנה חלבון קל וחזק יותר.[39] ה ל ו ד המוסכמה לתצורת חומצות אמיניות לא מתייחסת לפעילות האופטית של חומצת האמינו עצמה אלא לפעילות האופטית של האיזומר של גליצראלדהיד שממנו, בתיאוריה, ניתן לסנתז חומצת אמינו זו (דגליצרלדהיד הוא דה-טרורוטורטיבי; לבאופציה חלופית, ה- (ס) ו (ר) מעצבים משמשים לציון ה- תצורה מוחלטת. כמעט כל חומצות האמינו בחלבונים הן (ס) בפחמן α, עם ציסטאין להיות (ר) ו גליצין לֹאכיראלי.[40] לציסטאין שרשרת הצד שלה נמצאת באותו מיקום גיאומטרי כמו חומצות האמינו האחרות, אך ה- ר/ס המינוח הפוך כי גוֹפרִית בעל מספר אטומי גבוה יותר בהשוואה לחמצן קרבוקסיל המעניק לשרשרת הצדדית עדיפות גבוהה יותר על ידי הכללים קאהן – אינגולד – פרלוג, ואילו האטומים ברוב שרשראות הצד האחרות נותנים להם עדיפות נמוכה יותר בהשוואה לקבוצת הקרבוקסיל.[41]
שרשראות צד
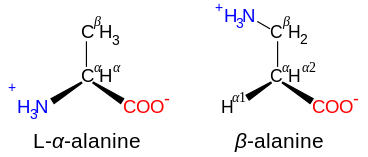
חומצות אמינו מוגדרות כ- α כאשר אטום החנקן מחובר לאטום הפחמן הסמוך לקבוצת הקרבוקסיל: במקרה זה התרכובת מכילה את התשתית N – C – CO2. חומצות אמינו בעלות מבנה המשנה N – C – C – CO2 מסווגות כחומצות אמיניות β. חומצות אמינו γ מכילות את התשתית N – C – C – C – CO2, וכן הלאה.[42]
חומצות אמינו מסווגות בדרך כלל לפי נכסים של שרשרת הצד שלהם לארבע קבוצות. השרשרת הצדדית יכולה ליצור חומצת אמינו a חומצה חלשה או א בסיס חלש, ו הידרופיל אם השרשרת הצדדית היא קוֹטבִי או א הידרופוב אם זה לא קוטבי.[35] הביטוי "חומצות אמינו מסועפות "או BCAA מתייחס לחומצות האמיניות שיש אליפטי שרשראות צד שהן לינאריות; אלו הם לאוצין, איזולאוצין, ו ואלין. פרולין היחיד חלבון חומצת אמינו שקבוצת הצד שלהן מתקשרת לקבוצת α- אמינו, ולכן היא גם חומצת האמינו הפרוטאוגנית היחידה המכילה אמין משני במצב זה.[35] במונחים כימיים, פרולין הוא, אם כן, חומצת אימינו, מכיוון שחסר בו א קבוצת אמינו ראשונית,[43] למרות שהיא עדיין מסווגת כחומצת אמינו במינוח הביוכימי הנוכחי[44] ואפשר לקרוא לו גם "נחומצה אלפא-אמינית מסודרת ".[45]
Zwitterions

בתמיסה מימית חומצות אמינו קיימות בשתי צורות (כפי שמודגם מימין), הצורה המולקולרית ו- zwitterion צורה בשיווי משקל זה עם זה. שתי הצורות מתקיימות יחד בטווח ה- pH עמ 'ק1 − 2 ל עמ 'ק2 + 2אשר עבור גליצין הוא pH 0–12. יחס הריכוזים של שני האיזומרים אינו תלוי ב- pH. לא ניתן לקבוע את ערך יחס זה בניסוי.
מכיוון שכל חומצות האמינו מכילות קבוצות פונקציונליות של אמין וחומצה קרבוקסילית, הן כן אמפיפרוטי.[35] בְּ pH = pק1 (בערך 2.2) יהיה ריכוז שווה של המין NH+
3CH (R) CO
2ה ו NH+
3CH (R) CO−
2 וב- pH = pק2 (בערך 10) יהיה ריכוז שווה של המין NH+
3CH (R) CO−
2 ו NH
2CH (R) CO−
2. מכאן נובע כי המולקולה הנייטרלית והזוויטריון הם למעשה המינים היחידים הנמצאים ב- pH ביולוגי.[46]
בדרך כלל מניחים כי ריכוז הצוויטריון גדול בהרבה מריכוז המולקולה הנייטרלית על בסיס השוואות עם ה- p הידוע.ק ערכים של אמינים ו חומצות קרבוקסיליות.
נקודה איזואלקטרית

בערכי pH בין השניים עמ 'קא ערכים, השוויטריון שולט, אך מתקיים במקביל שיווי משקל דינמי עם כמויות קטנות של יונים שליליים נטו וחיובי נטו. בנקודת האמצע המדויקת בין השניים עמ 'קא ערכים, כמות העקבות של שלילי נטו ועקבות של יונים חיוביים נטו מאזנות בדיוק, כך שהמטען הנקי הממוצע של כל הצורות הנוכחיות הוא אפס.[47] PH זה מכונה ה- נקודה איזואלקטרית עמ 'אני, אז עמ 'אני = 1/2(עמ 'קa1 + עמ 'קa2). עבור חומצות אמינו עם שרשראות צד טעונות, העמ 'קא של השרשרת הצדדית מעורב. לפיכך לאספרטט או גלוטמט עם שרשראות צד שליליות, עמ 'אני = 1/2(עמ 'קa1 + עמ 'קא (R)), שם עמ 'קא (R) היא השרשרת הצדדית pקא. לציסטאין יש גם שרשרת צדדית שעלולה להיות שלילית עם pקא (R) = 8.14, אז עמ 'אני צריך להיות מחושב כמו עבור אספרטט וגלוטמט, למרות ששרשרת הצד אינה טעונה באופן משמעותי ב pH פיזיולוגי. עבור היסטידין, ליזין וארגינין עם שרשראות צד חיוביות, עמאני = 1/2(עמ 'קא (R) + עמ 'קa2). לחומצות אמינו אפס ניידות באלקטרופורזה בנקודה האיזואלקטרית שלהן, אם כי בדרך כלל מנצלים התנהגות זו עבור פפטידים וחלבונים מאשר חומצות אמינו בודדות. לשוויטרונים יש מסיסות מינימלית בנקודה האיזואלקטרית שלהם, וחומצות אמינו מסוימות (בפרט עם שרשראות צד לא קוטביות) ניתנות לבידוד על ידי משקעים במים על ידי התאמת ה- pH לנקודה האיזואלקטרית הנדרשת.
התרחשות ותפקודים בביוכימיה
חומצות אמינו חלבוניות
חומצות אמינו הן היחידות המבניות (מונומרים ) המרכיבים חלבונים. הם מצטרפים יחד כדי ליצור קצר פּוֹלִימֵר שרשראות נקראו פפטידים או שרשראות ארוכות יותר נקראות פוליפפטידים אוֹ חלבונים. פולימרים אלה הם ליניאריים ולא מסועפים, כאשר כל חומצת אמינו בתוך השרשרת מחוברת לשתי חומצות אמינו שכנות. תהליך ייצור החלבונים המקודדים על ידי חומר גנטי של DNA / RNA נקרא תִרגוּם וכרוך בתוספת שלב אחר שלב של חומצות אמינו לשרשרת חלבונים הגדלה על ידי a ריבוזים זה נקרא a ריבוזום.[48] סדר הוספת חומצות האמינו נקרא דרך ה- קוד גנטי מ- mRNA תבנית, שהיא RNA עותק של אחד האורגניזם גנים.
עשרים ושניים חומצות אמינו משולבות באופן טבעי בפוליפפטידים ונקראות חלבון או חומצות אמינו טבעיות.[35] מתוכם 20 מקודדים על ידי האוניברסלי קוד גנטי. שני הנותרים, סלנוציסטאין ו פירוליזין, משולבים בחלבונים על ידי מנגנונים סינתטיים ייחודיים. סלנוציסטאין משולב כאשר ה- mRNA המתורגם כולל א אלמנט SECIS, מה שגורם לקודן ה- UGA לקודד סלנוציסטאין במקום a עצור קודון.[49] פירוליזין משמש חלקם מתנוגני ארכאה באנזימים שהם משתמשים בהם כדי לייצר מתאן. הוא מקודד עם קודון UAG, שהוא בדרך כלל קודון עצור באורגניזמים אחרים.[50] קודון UAG זה ואחריו א רצף במורד הזרם של PYLIS.[51]
מספר מחקרי אבולוציה עצמאיים, המשתמשים בסוגים שונים של נתונים, העלו כי גלי, עלא, אספ, ואל, סר, פרו, גלו, לאו, ת'ר עשויים להשתייך לקבוצה של חומצות אמינו שהיוו את הקוד הגנטי המוקדם, ואילו Cys, Met , Tyr, Trp, His, Phe עשוי להשתייך לקבוצה של חומצות אמינו שהיוו תוספות מאוחרות יותר של הקוד הגנטי.[52][53][54][55]
חומצות אמינו שאינן חלבוניות
מלבד ה 22 חומצות אמינו חלבוניות, רב לא חלבון ידועות חומצות אמיניות. אלה לא נמצאים בחלבונים (למשל קרניטין, גאבא, לבותירוקסין ) או לא מיוצרים ישירות ובבידוד על ידי מכונות סלולריות סטנדרטיות (למשל, הידרוקספרולין ו סלנומטיונין ).
חומצות אמינו שאינן פרוטאוגניות נמצאות בחלבונים נוצרות על ידי שינוי לאחר תרגום, שהוא שינוי לאחר התרגום במהלך סינתזת החלבון. שינויים אלה הם לעתים קרובות חיוניים לתפקוד או לוויסות של חלבון. לדוגמא, ה קרבוקסילציה שֶׁל גלוטמט מאפשר קישור טוב יותר של קטיוני סידן,[56] ו קולגן מכיל hydroxyproline, שנוצר על ידי הידרוקסילציה שֶׁל פרולין.[57] דוגמה נוספת היא היווצרות היפוזין בתוך ה גורם ייזום תרגום EIF5A, באמצעות שינוי שאריות ליזין.[58] שינויים כאלה יכולים גם לקבוע את לוקליזציה של החלבון, למשל, תוספת של קבוצות הידרופוביות ארוכות יכולה לגרום לחלבון להיקשר ל פוספוליפיד קְרוּם.[59]
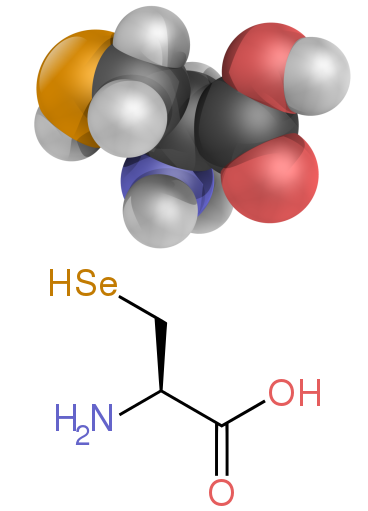
כמה חומצות אמינו שאינן חלבוניות אינן נמצאות בחלבונים. דוגמאות מכילות חומצה 2-אמינו-איזובוטירית והנוירוטרנסמיטר חומצה גמא-אמינו-בוטירית. חומצות אמינו שאינן חלבון-חלבון מופיעות לעיתים קרובות כמתווכות ב מסלולים מטבוליים לחומצות אמינו סטנדרטיות - למשל, אורניתין ו citrulline להתרחש ב מחזור אוריאה, חלק מחומצת אמינו יְרִידַת חֳמָרִים (ראה למטה).[60] חריג נדיר לדומיננטיות של חומצות א-אמינו בביולוגיה הוא חומצת אמינו בטא אלנין (חומצה 3-aminopropanoic), אשר משמש בצמחים ומיקרואורגניזמים בסינתזה של חומצה פנטותנית (ויטמין B5), מרכיב של קואנזים א.[61]
ד-חומצה אמינית שפע טבעי
החלק הזה צריך להיות מְעוּדכָּן. (יולי 2019) |
למרות ש ד- איזומרים אינם שכיחים באורגניזמים חיים, גרמיצידין הוא פוליפפטיד המורכב מתערובת של ד- ו ל-חומצות אמינו.[62] תרכובות אחרות המכילות דחומצות אמינו הן טירוקידין ו ולינומיצין. תרכובות אלו משבשות את קירות תאי החיידקים, במיוחד ב גרם חיובי בַּקטֶרִיָה. נכון לשנת 2011[עדכון], רק 837 דחומצות אמינו נמצאו ב שוויצרי-פרוט מסד נתונים מתוך סך של 187 מיליון חומצות אמינו שנותחו.[63]
חומצות אמינו לא תקניות
20 חומצות האמינו שמקודדות ישירות על ידי הקודונים של האוניברסלי קוד גנטי נקראים תֶקֶן אוֹ קנונית חומצות אמינו. צורה שונה של מתיונין (נ-פורמילתיונין ) משולב לעיתים קרובות במקום מתיונין כחומצת האמינו הראשונית של חלבונים בחיידקים, במיטוכונדריה ובכלורופלסטים. חומצות אמינו אחרות נקראות לא תקני אוֹ לא קנוני. מרבית חומצות האמינו הלא תקניות אינן גם חלבון (כלומר אינן יכולות להיכלל בחלבונים במהלך התרגום), אך שתיים מהן חלבוניות, שכן ניתן לשלב אותן בתרגום לחלבונים על ידי ניצול מידע שאינו מקודד בקוד הגנטי האוניברסלי.
שתי חומצות האמינו החלבוניות הלא תקניות הן סלנוציסטאין (קיים ברבים מהאיקריוטים כמו גם ברוב האיקריוטים, אך לא מקודד ישירות על ידי DNA) ו- פירוליזין (נמצא רק בחלק ארכאה ואחד חיידק ). שילוב של חומצות אמינו לא תקניות אלה הוא נדיר. לדוגמה, 25 חלבונים אנושיים כוללים סלנוציסטאין במבנה העיקרי שלהם,[64] והאנזימים המאופיינים באופן מבני (סלניואנזימים) משתמשים בסלנוציסטאין כקטליז מַחֲצִית באתרים הפעילים שלהם.[65] פירוליזין וסלנוציסטאין מקודדים באמצעות קודונים משתנים. לדוגמא, סלנוסטיסטין מקודד על ידי עצור קודון ו אלמנט SECIS.[11][12][13]
בתזונת האדם

כאשר הם נלקחים לגוף האדם מהתזונה, 20 חומצות האמינו הסטנדרטיות משמשות לסינתזת חלבונים, ביומולקולות אחרות או מחומצנות ל אוריאה ו פחמן דו חמצני כמקור אנרגיה.[66] מסלול החמצון מתחיל עם הסרת קבוצת האמינו על ידי a טרנסמינאז; קבוצת האמינו מוזנת ואז לתוך מחזור אוריאה. התוצר האחר של טרנסאמידמציה הוא א חומצת קטו שנכנס ל מעגל החומצה הציטרית.[67] חומצות אמינו גלוקוגניות ניתן להמיר גם לגלוקוז, דרך גלוקונאוגנזה.[68] מתוך 20 חומצות האמינו הסטנדרטיות, תשע (שֶׁלוֹ, איל, לאו, ליס, נפגש, פה, Thr, Trp ו ואל ) נקראים חומצות אמינו חיוניות בגלל ה גוף האדם לא יכול לסנתז אותם מאחרים תרכובות ברמה הדרושה לצמיחה תקינה, ולכן יש להשיג אותם מהמזון.[69][70][71] בנוסף, ציסטאין, טירוזין, ו ארגינין נחשבות לחומצות אמינו חצי-חיוניות, וטאורין הוא חומצה אמינו-סולפונית חצי-חיונית אצל ילדים. המסלולים המטבוליים המסנתזים מונומרים אלה אינם מפותחים לחלוטין.[72][73] הכמויות הנדרשות תלויות גם בגיל ובריאותו של האדם, ולכן קשה להצהיר הצהרות כלליות לגבי הדרישה התזונתית לחומצות אמינו מסוימות. חשיפה תזונתית לחומצת האמינו הלא תקנית BMAA נקשר למחלות ניווניות ניווניות בבני אדם, כולל ALS.[74][75]
• הרשות הפלסטינית: חומצה פוספטידית
• mTOR: יעד מכני של רפמיצין
• מגבר: אדנוזין מונופוספט
• ATP: אדנוזין טרי פוספט
• AMPK: קינאז חלבון המופעל על ידי AMP
• PGC ‐ 1α: פרוקסיזום מפזר מופעל קולטן גמא coactivator-1α
• S6K1: p70S6 קינאז
• 4EBP1: גורם התחלת תרגום אוקריוטי 4 גורם חלבון המחייב 1
• eIF4E: גורם התחלת תרגום איקריוטי 4E
• RPS6: חלבון ריבוזומלי S6
• eEF2: גורם התארכות איקריוטי 2
• RE: תרגיל התנגדות; EE: תרגיל סיבולת
• מיו: מיופיברילרית; מיטו: מיטוכונדריאלי
• AA: חומצות אמינו
• HMB: β-hydroxy β-methylbutyric acid
• ↑ מייצג הפעלה
• Τ מייצג עכבה
פונקציות שאינן חלבון
בבני אדם, לחומצות אמינו שאינן חלבון יש תפקידים חשובים גם כ- ביניים מטבוליים, כגון בביוסינתזה של ה- נוירוטרנסמיטר חומצה גמא-אמינו-בוטירית (גאבא). חומצות אמינו רבות משמשות לסינתזת מולקולות אחרות, למשל:
- טריפטופן הוא מבשר של הנוירוטרנסמיטר סרוטונין.[82]
- טירוזין (ומבשרו פנילאלנין) הם קודמיו של קטכולאמין נוירוטרנסמיטרים דופמין, אפינפרין ו נוראדרנלין ושונים עקבות אמינים.
- פנילאלנין הוא מבשר של פנאתילאמין וטירוזין בבני אדם. בצמחים, זה מבשר של שונים פנילפרופנואידים, החשובים בחילוף החומרים של הצמחים.
- גליצין הוא מבשר של פורפירינים כמו heme.[83]
- ארגינין הוא מבשר של תחמוצת חנקן.[84]
- אורניתין ו ס-אנוזילמתיונין הם קודמים ל פוליאמינים.[85]
- אספרטט, גליצין, ו גלוטמין הם קודמים ל נוקלאוטידים.[86] עם זאת, לא כל הפונקציות של חומצות אמינו אחרות שאינן תקנות בשפע ידועות.
כמה חומצות אמינו לא תקניות משמשות כ הגנה מפני אוכלי עשב בצמחים.[87] לדוגמה, קנוונין הוא אנלוגי של ארגינין שנמצא אצל רבים קטניות,[88] ובכמויות גדולות במיוחד ב קנאבליה גלדיאטה (שעועית חרב).[89] חומצת אמינו זו מגנה על הצמחים מפני טורפים כגון חרקים ועלולה לגרום למחלות אצל אנשים אם סוגים מסוימים של קטניות נאכלים ללא עיבוד.[90] חומצת האמינו שאינה חלבונית מימוזינה נמצא במינים אחרים של קטניות, בפרט Leucaena leucocephala.[91] תרכובת זו היא אנלוגיה של טירוזין ויכולים להרעיל בעלי חיים הרועים על צמחים אלה.
שימושים בתעשייה
חומצות אמינו משמשות למגוון יישומים בתעשייה, אך השימוש העיקרי בהן הוא כתוספים ל מזון לבעלי חיים. זה הכרחי, מכיוון שרבים מהרכיבים העיקריים של הזנות אלה, כגון פולי סויה, או שיש להם רמות נמוכות או שחסרים להם חלק מה חומצות אמינו חיוניות: ליזין, מתיונין, תראונין וטריפטופן הם החשובים ביותר בייצור הזנות הללו.[92] בתעשייה זו, חומצות אמינו משמשות גם לכילת קטיונים של מתכות על מנת לשפר את ספיגת המינרלים מתוספי מזון, אשר עשויים להידרש לשיפור בריאותם או ייצורם של בעלי חיים אלה.[93]
ה תעשיית המזון הוא גם צרכן מרכזי של חומצות אמינו, בפרט, חומצה גלוטמית, המשמש כ- משפר טעם,[94] ו אספרטיים (אספרטילפנילאלנין 1-מתיל אסטר) כקלוריות דלות ממתיק מלאכותי.[95] טכנולוגיה דומה לזו המשמשת לתזונה מן החי משמשת בתעשיית התזונה האנושית בכדי להקל על תסמינים של מחסור במינרלים, כגון אנמיה, על ידי שיפור ספיגת המינרלים והפחתת תופעות לוואי שליליות כתוספת של מינרלים אנאורגניים.[96]
יכולת הכלציה של חומצות אמינו שימשה בדשנים לחקלאות כדי להקל על העברת מינרלים לצמחים על מנת לתקן מחסור במינרלים, כגון כלורוזיס בברזל. דשנים אלה משמשים גם למניעת התרחשות ליקויים ושיפור בריאותם הכללית של הצמחים.[97] הייצור הנותר של חומצות אמינו משמש לסינתזה של סמים ו קוסמטיקה.[92]
באופן דומה, נגזרות חומצות אמיניות מסוימות משמשות בתעשיית התרופות. הם כוללים 5-HTP (5-hydroxytryptophan) המשמש לטיפול ניסיוני בדיכאון,[98] ל-DOPA (ל-דיהידרוקסיפנילאלנין) עבור פרקינסון יַחַס,[99] ו eflornithine תרופה המעכבת אורניטין דקארבוקסילאז ומשמש לטיפול ב מחלת שינה.[100]
קוד גנטי מורחב
מאז 2001, 40 חומצות אמינו לא טבעיות נוספו לחלבון על ידי יצירת קודון ייחודי (קידוד מחדש) והעברת RNA תואם: aminoacyl - tRNA-synthetase כדי לקודד אותו בתכונות פיזיקוכימיות וביולוגיות מגוונות כדי לשמש כ כלי לחקר מבנה חלבון ולתפקד או ליצור חלבונים חדשים או משופרים.[14][15]
Nullomers
Nullomers הם קודונים שבתיאוריה מקודדים חומצת אמינו, אולם בטבע יש הטיה סלקטיבית נגד שימוש בקודון זה לטובת אחר, למשל חיידקים מעדיפים להשתמש ב- CGA במקום ב- AGA כדי לקודד לארגינין.[101] זה יוצר כמה רצפים שלא מופיעים בגנום. ניתן לנצל מאפיין זה ולהשתמש בו כדי ליצור תרופות סלקטיביות חדשות למלחמה בסרטן[102] ולמנוע זיהום צולב של דגימות DNA מחקירות זירת פשע.[103]
אבני בניין כימיות
חומצות אמינו חשובות כעלות נמוכה חומרי הזנה. משתמשים בתרכובות אלה ב סינתזת בריכה כיראלית כפי ש טהור אננטי-אנומרית אבני בניין.[104]
חומצות אמינו נחקרו כמבשר זרזים כיראליים, כגון לא-סימטרי הידרוגנציה תגובות, אם כי אין יישומים מסחריים.[105]
פלסטיק מתכלה
חומצות אמינו נחשבו כמרכיבים של פולימרים מתכלים, שיש להם יישומים כמו ידידותי לסביבה אריזה וברפואה ב משלוח סמים ובניית שתלים תותבת.[106] דוגמא מעניינת לחומרים כאלה היא פוליאספרט, פולימר מתכלה מתמוסס במים שעשוי להיות בעל יישום חד פעמי חִתוּלִים וחקלאות.[107] בשל מסיסותו ויכולתו chelate יוני מתכת, פוליאספרט משמש גם כנוגד מתכלהדֵרוּג סוכן ו מעכב קורוזיה.[108][109] בנוסף, חומצת האמינו הארומטית טירוזין נחשב כתחליף אפשרי עבור פנולים כמו ביספינול א בייצור של פוליקרבונטים.[110]
סִינתֶזָה

סינתזה כימית
הייצור המסחרי של חומצות אמינו מסתמך בדרך כלל על חיידקים מוטנטים המייצרים יתר על המידה חומצות אמינו בודדות באמצעות גלוקוז כמקור פחמן. חלק מחומצות האמינו מיוצרות על ידי המרות אנזימטיות של ביניים סינתטיים. 2-Aminothiazoline-4-carboxylic acid הוא ביניים בסינתזה תעשייתית אחת של ל-ציסטאין לדוגמה. חומצה אספרטית מיוצר על ידי תוספת של אמוניה ל- מקטרת באמצעות lyase.[111]
ביוסינתזה
בצמחים, חנקן נטמע לראשונה בתרכובות אורגניות בצורה של גלוטמט, נוצר מאלפא-קטוגלוטרט ואמוניה במיטוכונדריה. עבור חומצות אמינו אחרות, צמחים משתמשים טרנסמינאזות להעביר את קבוצת האמינו מגלוטמט לחומצה אלפא-קטו אחרת. לדוגמה, אמינוטרנספרנאז אספרטט ממיר גלוטמט ואוקסאלואצטט לאלפא-קטוגלוטרט ואספרטט.[112] אורגניזמים אחרים משתמשים גם בטרנסמינאזות לצורך סינתזת חומצות אמינו.
חומצות אמינו לא תקניות נוצרות בדרך כלל באמצעות שינויים בחומצות אמינו סטנדרטיות. לדוגמה, הומוציסטאין נוצר דרך ה מסלול גופרית או על ידי דמטילציה של מתיונין דרך מטבוליט הביניים ס-אנוזילמתיונין,[113] בזמן הידרוקספרולין מיוצר על ידי א פרסם שינוי תרגום שֶׁל פרולין.[114]
מיקרואורגניזמים וצמחים מסנתזים חומצות אמינו לא שכיחות רבות. לדוגמה, כמה חיידקים מייצרים חומצה 2-אמינו-איזובוטירית ו לנטיונין, שהוא נגזרת מגושרת גופרית של אלנין. שתי חומצות האמינו הללו נמצאות בפפטידיות לנטיביוטיקה כמו אלמתיצין.[115] עם זאת, בצמחים, 1-aminocyclopropane-1-carboxylic acid הינה חומצת אמינו מחזורית קטנה מחולקת המהווה גורם ביניים מרכזי בייצור הורמון הצמח אתילן.[116]
תגובות
חומצות אמינו עוברות את התגובות הצפויות לקבוצות הפונקציונליות המרכיבות.[117][118]
יצירת קשרי פפטיד
מכיוון שקבוצות החומצות האמיניות והחומצות הקרבוקסיליות של חומצות אמינו יכולות להגיב ליצירת קשרים אמידיים, מולקולה אחת של חומצות אמינו יכולה להגיב עם אחרת ולהצטרף דרך הצמדת אמיד. זֶה פילמור של חומצות אמינו הוא זה שיוצר חלבונים. זֶה תגובת דחיסה מניב את החדש שנוצר קשר פפטיד ומולקולת מים. בתאים, תגובה זו אינה מתרחשת באופן ישיר; במקום זאת, חומצת האמינו מופעלת תחילה על ידי הצמדה ל- a העברת RNA מולקולה דרך אסתר אגרת חוב. זה aminoacyl-tRNA מיוצר ב ATP תגובה תלויה שבוצעה על ידי סינתטאז tRNA אמינוציל.[119] זה aminoacyl-tRNA הוא אז מצע עבור ריבוזום, שמזרז את ההתקפה של קבוצת האמינו של שרשרת החלבונים המאריכה על הקשר האסטר.[120] כתוצאה ממנגנון זה, כל החלבונים המיוצרים על ידי ריבוזומים מסונתזים החל משלהם נ-מינוס ונע לעבר שלהם ג-מָסוּף.
עם זאת, לא כל קשרי הפפטיד נוצרים בצורה זו. במקרים ספורים, פפטידים מסונתזים על ידי אנזימים ספציפיים. למשל הטריפפטיד גלוטתיון הוא חלק חיוני מההגנה על תאים מפני מתח חמצוני. פפטיד זה מסונתז בשני שלבים מחומצות אמינו חופשיות.[121] בשלב הראשון, גמא-גלוטאמילציסטאין סינתזה מתעבה ציסטאין ו חומצה גלוטמית דרך קשר פפטיד שנוצר בין שרשרת הצדדית קרבוקסיל של הגלוטמט (פחמן הגמא של שרשרת צדדית זו) לבין קבוצת האמינו של ציסטאין. לאחר מכן מתמצה בדיפפטיד הזה גליצין על ידי גלוטתיון סינתטאז ליצור גלוטתיון.[122]
בכימיה, פפטידים מסונתזים על ידי מגוון תגובות. אחד הנפוצים ביותר ב- סינתזת פפטיד בשלב מוצק משתמש בנגזרות האוקסימ הארומטיות של חומצות אמינו כיחידות מופעלות. אלה מתווספים ברצף על שרשרת הפפטיד הגדלה, המחוברת לתומך שרף מוצק.[123] ספריות של פפטידים משמשות לגילוי תרופות באמצעות סינון תפוקה גבוהה.[124]
השילוב של קבוצות פונקציונליות מאפשר לחומצות אמינו להיות ליגנדים פולידנטטיים יעילים עבור צ'לטי מתכת – חומצות אמינו.[125]שרשראות הצד המרובות של חומצות אמינו יכולות לעבור גם תגובות כימיות.
יְרִידַת חֳמָרִים

* גלוקוגני, כאשר למוצרים יש יכולת להיווצר גלוקוז על ידי גלוקונאוגנזה
* קטוגני, כאשר למוצרים אין יכולת ליצור גלוקוז. מוצרים אלה עשויים עדיין לשמש קטוגנזה אוֹ סינתזת שומנים בדם.
* חומצות אמינו הצטמצמו למוצרים גלוקוגניים וקטוגניים כאחד.
תחילה חייבות חומצות אמינו לעבור מאברונים ותאים למחזור הדם דרך מובילי חומצות אמיניות, מכיוון שקבוצות האמין והחומצה הקרבוקסילית מיוננות בדרך כלל. פירוק של חומצת אמינו, המתרחשת בכבד ובכליות, כרוך לעיתים קרובות דיאמינציה על ידי העברת קבוצת האמינו שלה לאלפא-קטוגלוטרט, ויוצרים גלוטמט. תהליך זה כולל טרנסאמינאזות, לעתים קרובות זהות לאלה המשמשים להפסקה במהלך הסינתזה. אצל בעלי חוליות רבים, קבוצת האמינו מוסרת דרך מחזור אוריאה ומופרש בצורה של אוריאה. עם זאת, השפלה של חומצות אמיניות יכולה לייצר חומצת שתן או אמוניה במקום. לדוגמה, סרין דהידראטאז ממיר סרין לפירובט ואמוניה.[86] לאחר הסרת קבוצה אחת או יותר מקבוצות אמיניות ניתן להשתמש בשארית המולקולה לסינתזה של חומצות אמינו חדשות, או להשתמש בה לאנרגיה על ידי כניסה גליקוליזה או ה מעגל החומצה הציטרית, כמפורט בתמונה מימין.
מורכבות
חומצות אמינו הן ליגנדים דו-צדדיים, ויוצרים מתחמי חומצות אמינו של מתכת מעבר.[127]
תכונות פיסיקוכימיות של חומצות אמינו
כ. ניתן לסווג 20 חומצות אמינו קנוניות על פי תכונותיהן. גורמים חשובים הם תשלום, הידרופיליות אוֹ הידרופוביות, גודל וקבוצות פונקציונליות.[35] תכונות אלה משפיעות מבנה חלבון ו אינטראקציות בין חלבון לחלבון. לחלבונים המסיסים במים יש שאריות הידרופוביות שלהם (לאו, איל, ואל, פה, ו Trp ) קבור באמצע החלבון, ואילו שרשראות צד הידרופיליות נחשפות לממיס המימי. (שים לב שב- בִּיוֹכִימִיָה, שאריות מתייחס ספציפי מונומר בתוך ה שרשרת פולימרית של א פוליסכריד, חֶלְבּוֹן אוֹ חומצות גרעין.) ה חלבוני קרום אינטגרליים נוטים להיות בעלי טבעות חיצוניות של חשופים הידרופובי חומצות אמינו המעגנות אותן לתוך שכבה דו-שכבתית. כמה חלבוני קרום היקפיים יש על פניהם כתם של חומצות אמינו הידרופוביות הננעלות על הממברנה. באופן דומה, לחלבונים שצריכים להיקשר למולקולות טעונות חיוביות יש משטחים עשירים בחומצות אמינו בעלות מטען שלילי כמו גלוטמט ו אספרטט בעוד שלחלבונים הנקשרים למולקולות טעונות שלילית יש משטחים עשירים בשרשראות טעונות חיוביות כמו ליזין ו ארגינין. לדוגמא, ליזין וארגינין מועשרים מאוד ב אזורי מורכבות נמוכה של חלבונים המחייבים חומצות גרעין.[55] יש שונים סולמות הידרופוביות של שאריות חומצות אמיניות.[128]
לחומצות אמינו מסוימות תכונות מיוחדות כגון ציסטאין, שיכול להיווצר קוולנטי קשרים דיסולפידיים לשאריות ציסטאין אחרות, פרולין שמתהווה מחזור לעמוד השדרה הפוליפפטיד, ו גליצין שהוא גמיש יותר מחומצות אמינו אחרות.
יתר על כן, גליצין ופרולין מועשרים מאוד בפנים אזורי מורכבות נמוכה של חלבונים אוקריוטיים ופרוקריוטים, ואילו ההפך (מיוצג מתחת) נצפה עבור חומצות אמינו מאוד תגובתיות, או מורכבות או הידרופוביות, כגון ציסטאין, פנילאלנין, טריפטופן, מתיונין, ואלין, לאוצין, איזולאוצין.[55][129][130]
חלבונים רבים עוברים מגוון של שינויים שלאחר התרגום, לפיה קבוצות כימיות נוספות מחוברות לשרשראות הצד של חומצות האמיניות. שינויים מסוימים יכולים לייצר הידרופובי ליפופרוטאינים,[131] או הידרופילי גליקופרוטאינים.[132] סוג זה של שינוי מאפשר מיקוד הפיך של חלבון לקרום. לדוגמא, תוספת והוצאת חומצת השומן חומצת פלמיטית לשאריות ציסטאין בכמה חלבוני איתות גורם לחלבונים להיקשר ואז להתנתק מקרומי התא.[133]
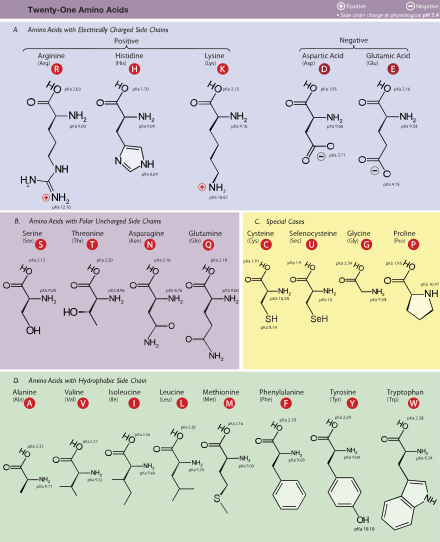
טבלה של קיצורים ותכונות של חומצות אמינו סטנדרטיות
| חומצת אמינו | קוד אותיות | שרשרת צד | הידרופתיה אינדקס[134] | ספיגת טוחנות[135] | מסה מולקולרית | שפע בחלבונים (%)[136] | קידוד גנטי סטנדרטי, סימון IUPAC | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | 1 | מעמד | קוטביות[137] | טעינה, ב- pH 7.4[137] | אֹרֶך גַל, λמקסימום (ננומטר) | מְקַדֵם, ε (מ"מ−1·ס"מ−1) | |||||
| אלנין | עלא | א | אליפטי | לא קוטבי | ניטראלי | 1.8 | 89.094 | 8.76 | GCN | ||
| ארגינין | ארג | ר | בסיסי | קוטב בסיסי | חִיוּבִי | −4.5 | 174.203 | 5.78 | MGR, CGY (קידודים קידוד יכולים לבוא לידי ביטוי גם על ידי: CGN, AGR) | ||
| אספרגין | אסן | נ | אמיד | קוֹטבִי | ניטראלי | −3.5 | 132.119 | 3.93 | AAY | ||
| חומצה אספרטית | אֶפעֶה | ד | חוּמצָה | קוטבי חומצי | שלילי | −3.5 | 133.104 | 5.49 | גיי | ||
| ציסטאין | Cys | ג | גוֹפרָתִי | לא קוטבי | ניטראלי | 2.5 | 250 | 0.3 | 121.154 | 1.38 | אוגי |
| גלוטמין | גלן | ש | אמיד | קוֹטבִי | ניטראלי | −3.5 | 146.146 | 3.9 | אוטו | ||
| חומצה גלוטמית | Glu | ה | חוּמצָה | קוטבי חומצי | שלילי | −3.5 | 147.131 | 6.32 | GAR | ||
| גליצין | גלי | ז | אליפטי | לא קוטבי | ניטראלי | −0.4 | 75.067 | 7.03 | GGN | ||
| היסטידין | שֶׁלוֹ | ה | בסיסי ארומטי | קוטב בסיסי | חיובי, 10% ניטראלי, 90% | −3.2 | 211 | 5.9 | 155.156 | 2.26 | קיי |
| איזולאוצין | איל | אני | אליפטי | לא קוטבי | ניטראלי | 4.5 | 131.175 | 5.49 | AUH | ||
| לאוצין | לאו | ל | אליפטי | לא קוטבי | ניטראלי | 3.8 | 131.175 | 9.68 | YUR, CUY (קידודים קידוד יכולים לבוא לידי ביטוי על ידי: CUN, UUR) | ||
| ליזין | ליס | ק | בסיסי | קוטב בסיסי | חִיוּבִי | −3.9 | 146.189 | 5.19 | AAR | ||
| מתיונין | נפגש | M | גוֹפרָתִי | לא קוטבי | ניטראלי | 1.9 | 149.208 | 2.32 | אוג | ||
| פנילאלנין | פה | F | אֲרוֹמָתִי | לא קוטבי | ניטראלי | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 | 165.192 | 3.87 | UUY |
| פרולין | מִקצוֹעָן | פ | מַחזוֹרִי | לא קוטבי | ניטראלי | −1.6 | 115.132 | 5.02 | CCN | ||
| סרין | סר | ס | הידרוקסיליק | קוֹטבִי | ניטראלי | −0.8 | 105.093 | 7.14 | UCN, AGY | ||
| תראונין | Thr | ט | הידרוקסיליק | קוֹטבִי | ניטראלי | −0.7 | 119.119 | 5.53 | ACN | ||
| טריפטופן | Trp | W | אֲרוֹמָתִי | לא קוטבי | ניטראלי | −0.9 | 280, 219 | 5.6, 47.0 | 204.228 | 1.25 | UGG |
| טירוזין | טייר | י | אֲרוֹמָתִי | קוֹטבִי | ניטראלי | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 | 181.191 | 2.91 | UAY |
| ואלין | ואל | ו | אליפטי | לא קוטבי | ניטראלי | 4.2 | 117.148 | 6.73 | אֶקְדָח | ||
שתי חומצות אמינו נוספות נמצאות בחלק מהמינים המקודדים על ידי קודונים שבדרך כלל מתפרשים כ עצור קודונים:
| חומצות אמינו 21-22 | 3 אותיות | אות אחת | מסה מולקולרית |
|---|---|---|---|
| סלנוציסטאין | סעיף | U | 168.064 |
| פירוליזין | פיל | או | 255.313 |
בנוסף לקודים של חומצות אמינו ספציפיות, משתמשים במצבי מיקום במקרים בהם כִּימִי אוֹ קריסטלוגרפי ניתוח של פפטיד או חלבון אינו יכול לקבוע באופן סופי את זהות שאריות. הם משמשים גם לסיכום רצף חלבונים משומר מוטיבים. השימוש באותיות בודדות לציון קבוצות של שאריות דומות דומה לשימוש ב קודי קיצור לבסיסים מנווונים.[138][139]
| חומצות אמינו דו משמעיות | 3 אותיות | אות אחת | חומצות אמינו כלולות | קודונים כלולים |
|---|---|---|---|---|
| כל / לא ידוע | Xaa | איקס | את כל | NNN |
| אספרגין או חומצה אספרטית | אסקס | ב | ד, נ | קֶרֶן |
| גלוטמין או חומצה גלוטמית | גלקס | ז | E, Q | SAR |
| לאוצין או איזולאוצין | Xle | י | אני, ל | YTR, ATH, CTY (קידודים קידוד יכולים לבוא לידי ביטוי גם על ידי: CTN, ATH, TTR; MTY, YTR, ATA; MTY, HTA, YTG) |
| הידרופובי | Φ | V, I, L, F, W, Y, M | NTN, TAY, TGG | |
| אֲרוֹמָתִי | Ω | F, W, Y, H | YWY, TTY, TGG (קידודים קידוד יכולים לבוא לידי ביטוי גם על ידי: TWY, CAY, TGG) | |
| אליפטי (לא ארומטי) | Ψ | V, I, L, M | VTN, TTR (קידודים קידוד יכולים לבוא לידי ביטוי גם על ידי: NTR, VTY) | |
| קָטָן | π | P, G, A, S | BCN, RGY, GGR | |
| הידרופילי | ζ | S, T, H, N, Q, E, D, K, R. | VAN, WCN, CGN, AGY (קידודים קידוד יכולים לבוא לידי ביטוי גם על ידי: VAN, WCN, MGY, CGP) | |
| טעון במטען חיובי | + | K, R, H | ARR, CRY, CGR | |
| טעונה שלילית | − | ד, ה | GAN |
לא בסדר משמש לפעמים במקום Xaa, אך הוא פחות סטנדרטי.
בנוסף, רבים חומצות אמינו לא תקניות יש קוד ספציפי. לדוגמא, כמה תרופות פפטיד, כגון בורטזומיב ו MG132, הם מסונתז באופן מלאכותי ולשמור על שלהם הגנה על קבוצות, שיש להם קודים ספציפיים. בורטזומיב הוא פייז –Phe – boroLeu, ו- MG132 הוא ז –Leu – Leu – Leu – al. כדי לסייע בניתוח מבנה החלבון, אנלוגים של חומצות אמינו בתגובה-פוטו פנויים. אלו כוללים פוטולאוצין (pLeu) ו פוטומתיונין (pMet).[140]
ניתוח כימי
תכולת החנקן הכוללת של חומר אורגני נוצרת בעיקר על ידי קבוצות האמינו בחלבונים. החנקן הכולל של Kjeldahl (TKN ) הוא מדד של חנקן שנמצא בשימוש נרחב בניתוח מים (פסולת), אדמה, מזון, מזון וחומרים אורגניים באופן כללי. כפי שהשם מרמז, ה שיטת Kjeldahl מוחל. קיימות שיטות רגישות יותר.[141][142]
ראה גם
הערות
- ^ פרולין הוא יוצא מן הכלל לנוסחה כללית זו. זה חסר את ה- NH2 הקבוצה בגלל מחזור של שרשרת הצד וידוע בשם חומצת אימינו; הוא נכנס לקטגוריה של חומצות אמינו מובנות מיוחדות.
- ^ לדוגמה, גידולים כגון פרות משיגות מספר חומצות אמינו באמצעות חיידקים בתוך ה שני תאי קיבה ראשונים.
הפניות
- ^ נלסון DL, קוקס MM (2005). עקרונות הביוכימיה (מהדורה רביעית). ניו יורק: וו. ה 'פרימן. ISBN 0-7167-4339-6.
- ^ "חומצת אמינו". מילוני קיימברידג 'ברשת. הוצאת אוניברסיטת קיימברידג '. 2015. הוחזר 3 ביולי 2015.
- ^ וגנר הראשון, מוסו ה '(נובמבר 1983). "חומצות אמינו חדשות באופן טבעי". המהדורה הבינלאומית Angewandte Chemie באנגלית. 22 (11): 816–828. דוי:10.1002 / anie.198308161.

- ^ Latham MC (1997). "פרק 8. הרכב הגוף, תפקודי המזון, חילוף חומרים ואנרגיה". תזונת האדם בעולם המתפתח. סדרת המזון והתזונה - מס '29. רומא: ארגון המזון והחקלאות של האומות המאוחדות.
- ^ קלארק, ג'ים (אוגוסט 2007). "מבוא לחומצות אמינו". chemguide. הוחזר 4 ביולי 2015.
- ^ Jakubke H, Sewald N (2008). "חומצות אמינו". פפטידים מא 'עד ת': אנציקלופדיה תמציתית. גרמניה: Wiley-VCH. עמ ' 20. ISBN 9783527621170 - באמצעות גוגל ספרים.
- ^ Pollegioni L, Servi S, עורכים. (2012). חומצות אמינו לא טבעיות: שיטות ופרוטוקולים. שיטות בביולוגיה מולקולרית. 794. הומאנה פרס. עמ ' v. דוי:10.1007/978-1-61779-331-8. ISBN 978-1-61779-331-8. OCLC 756512314. S2CID 3705304.
- ^ הרטווק C (אוקטובר 2011). "ביוסינתזה וטעינה של פירוליזין, חומצת אמינו המקודדת גנטית 22". המהדורה הבינלאומית Angewandte Chemie. 50 (41): 9540–9541. דוי:10.1002 / anie.201103769. PMID 21796749.

- ^ "פרק 1: חלבונים הם מולקולות העובד בגוף". מבני החיים. המכון הלאומי למדעי הרפואה הכלליים. 27 באוקטובר 2011. הוחזר 20 במאי 2008.
- ^ מיכל ג'י, שומבורג ד ', עורכים. (2012). מסלולים ביוכימיים: אטלס של ביוכימיה וביולוגיה מולקולרית (מהדורה שנייה). אוקספורד: וויילי-בלקוול. עמ ' 5. ISBN 978-0-470-14684-2.
- ^ א ב צ'ונג ה '(2008). דוגמנות תרומות אלקטרוסטטיות לקיפול חלבונים וקשירתם (עבודת דוקטורט). אוניברסיטת פלורידה. עמ ' הערת שוליים אחת.
- ^ א ב סטיוארט ל ', בורגין א.ב. (2005). אטא-אור-רחמן, ספרינגר BA, קלדוול GW (עורכים). "סינתזת גנים שלמה: עתיד גנטי-או-מטיק". גבולות בתכנון וגילוי סמים. הוצאת מדע של בנתם. 1: 299. דוי:10.2174/1574088054583318. ISBN 978-1-60805-199-1. ISSN 1574-0889.
- ^ א ב אלזנובסקי A, Ostell J (7 באפריל 2008). "הקודים הגנטיים". המרכז הלאומי למידע על ביוטכנולוגיה (NCBI). הוחזר 10 במרץ 2010.
- ^ א ב זי ג'יי, שולץ PG (דצמבר 2005). "הוספת חומצות אמינו לרפרטואר הגנטי". חוות הדעת הנוכחית בביולוגיה כימית. 9 (6): 548–554. דוי:10.1016 / j.cbpa.2005.10.011. PMID 16260173.
- ^ א ב וואנג Q, Parrish AR, Wang L (מרץ 2009). "הרחבת הקוד הגנטי למחקרים ביולוגיים". כימיה וביולוגיה. 16 (3): 323–336. דוי:10.1016 / j.chembiol.2009.03.001. PMC 2696486. PMID 19318213.
- ^ סיימון M (2005). חישוב מתפתח: הדגשת ביואינפורמטיקה. ניו יורק: AIP Press / ספרינגר מדע + מדיה עסקית. עמ.105–106. ISBN 978-0-387-22046-8.
- ^ פטרוף OA (דצמבר 2002). "גאבא וגלוטמט במוח האנושי". מדעי המוח. 8 (6): 562–573. דוי:10.1177/1073858402238515. PMID 12467378. S2CID 84891972.
- ^ ויקרי HB, שמידט CL (1931). "ההיסטוריה של גילוי חומצות האמינו". כימיה. לְהַאִיץ. 9 (2): 169–318. דוי:10.1021 / cr60033a001.
- ^ הנסן S (מאי 2015). "Die Entdeckung der proteinogenen Aminosäuren von 1805 בפריז עד 1935 באילינוי" (PDF) (בגרמנית). ברלין. הועבר לארכיון מ המקורי (PDF) ב -1 בדצמבר 2017.
- ^ ווקלין LN, Robiquet PJ (1806). "גילוי עקרון צמחי חדש באספרגוס סטיבוס". אנאלס דה צ'ימי. 57: 88–93.
- ^ א ב אנפינסן CB, אדסל JT, ריצ'רדס FM (1972). ההתקדמות בכימיה של חלבונים. ניו יורק: עיתונות אקדמית. עמ.99, 103. ISBN 978-0-12-034226-6.
- ^ וולסטון WH (1810). "על תחמוצת סיסטיק, זן חדש של חשבון שתן". עסקאות פילוסופיות של החברה המלכותית. 100: 223–230. דוי:10.1098 / rstl.1810.0015. S2CID 110151163.
- ^ באומן E (1884). "Über cystin und cystein". Z Physiol Chem. 8 (4): 299–305. הועבר לארכיון מ המקורי ב- 14 במרץ 2011. הוחזר 28 במרץ 2011.
- ^ Braconnot HM (1820). "Sur la conversion des matières animales en nouvelles חומרים par le moyen de l'acide sulfurique". Annales de Chimie et de Physique. סדרה 2. 13: 113–125.
- ^ סימוני RD, היל RL, ווהן M (ספטמבר 2002). "גילוי חומצת האמינו תראונין: יצירתו של ויליאם סי רוז [מאמר קלאסי]". כתב העת לכימיה ביולוגית. 277 (37): E25. PMID 12218068.
- ^ McCoy RH, Meyer CE, Rose WC (1935). "ניסויי האכלה בתערובות של חומצות אמינו מטוהרות מאוד. VIII. בידוד וזיהוי של חומצת אמינו חיונית חדשה". כתב העת לכימיה ביולוגית. 112: 283–302.
- ^ Menten, P. Dictionnaire de chimie: Une approche étymologique et historique. דה בוק, ברוקסל. קישור.
- ^ הארפר ד. "אמינו-". מילון אתיולוגיה מקוון. הוחזר 19 ביולי 2010.
- ^ פאעל ג '(1894). "Ueber die Einwirkung von Phenyl ‐ i ‐ cyanat auf organische Aminosäuren". Berichte der Deutschen Chemischen Gesellschaft. 27: 974–979. דוי:10.1002 / cber.189402701205. הועבר לארכיון מ המקורי ב 25 ביולי 2020.
- ^ פרוטון JS (1990). "פרק 5 - אמיל פישר ופרנץ הופמייסטר". ניגודים בסגנון מדעי: קבוצות מחקר במדעים כימיים וביוכימיים. 191. האגודה הפילוסופית האמריקאית. עמ '163–165. ISBN 978-0-87169-191-0.
- ^ "חומצת אמינו אלפא". מילון הרפואי Merriam-Webster.com. Merriam-Webster Inc.
- ^ פרולין בספרייה הלאומית לרפואה בארה"ב כותרות נושא רפואי (רֶשֶׁת)
- ^ Matts RL (2005). "חומצות אמינו". ביוכימיה 5753: עקרונות הביוכימיה. הועבר לארכיון מ המקורי ב- 18 בינואר 2008. הוחזר 3 בינואר 2015.
- ^ IUPAC, מכלול המינוח הכימי מהדורה שנייה ("ספר הזהב") (1997). גרסה מתוקנת מקוונת: (2006–) "חומצות אימינו ". דוי:10.1351 / goldbook.I02959
- ^ א ב ג ד ה f קרייטון TH (1993). "פרק 1". חלבונים: מבנים ותכונות מולקולריות. סן פרנסיסקו: וו. ה 'פרימן. ISBN 978-0-7167-7030-5.
- ^ Pisarewicz K, Mora D, Pflueger FC, Fields GB, Marí F (מאי 2005). "Polypeptide chains containing D-gamma-hydroxyvaline". כתב העת של האגודה האמריקנית לכימיה. 127 (17): 6207–6215. דוי:10.1021/ja050088m. PMID 15853325.
- ^ van Heijenoort J (March 2001). "היווצרות שרשראות הגליקאן בסינתזה של פפטידוגליקן חיידקי". גליקוביולוגיה. 11 (3): 25R – 36R. דוי:10.1093 / גליקוב / 11.3.25R. PMID 11320055. S2CID 46066256.
- ^ Wolosker H, Dumin E, Balan L, Foltyn VN (July 2008). "ד-Amino acids in the brain: ד-serine in neurotransmission and neurodegeneration". כתב העת FEBS. 275 (14): 3514–3526. דוי:10.1111/j.1742-4658.2008.06515.x. PMID 18564180.
- ^ Matthews BW (June 2009). "קריסטלוגרפיה גזעית - גבישים קלים ומבנים קלים: מה לא אוהב?". מדע חלבונים. 18 (6): 1135–1138. דוי:10.1002 / פרו.125. PMC 2774423. PMID 19472321.
- ^ Hatem SM (2006). "Gas chromatographic determination of Amino Acid Enantiomers in tobacco and bottled wines". אוניברסיטת גיסן. הועבר לארכיון מ המקורי ב- 22 בינואר 2009. הוחזר 17 בנובמבר 2008.
- ^ Mitchell B (2019). ביולוגיה של תאים ומולקולרים. משאבים אלקטרוניים מדעיים. pp. 294–29 5. ISBN 9781839474460.
- ^ "Nomenclature and Symbolism for Amino Acids and Peptides". IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. בארכיון מ המקורי ב- 9 באוקטובר 2008. הוחזר 17 בנובמבר 2008.
- ^ Jodidi SL (1 March 1926). "The Formol Titration of Certain Amino Acids". כתב העת של האגודה האמריקנית לכימיה. 48 (3): 751–753. דוי:10.1021/ja01414a033.
- ^ Liebecq C, ed. (1992). המינוח הביוכימי ומסמכים קשורים (מהדורה שנייה). הוצאת פורטלנד. pp. 39–69. ISBN 978-1-85578-005-7.
- ^ Smith AD (1997). מילון אוקספורד לביוכימיה וביולוגיה מולקולרית. אוקספורד: הוצאת אוניברסיטת אוקספורד. עמ ' 535. ISBN 978-0-19-854768-6. OCLC 37616711.
- ^ Simmons WJ, Meisenberg G (2006). Principles of medical biochemistry. מוסבי אלסבייה. עמ '19. ISBN 978-0-323-02942-1.
- ^ Fennema OR (19 June 1996). Food Chemistry 3rd Ed. עיתונות CRC. עמ '327–328. ISBN 978-0-8247-9691-4.
- ^ Rodnina MV, Beringer M, Wintermeyer W (January 2007). "How ribosomes make peptide bonds". מגמות במדעים ביוכימיים. 32 (1): 20–26. דוי:10.1016/j.tibs.2006.11.007. PMID 17157507.
- ^ Driscoll DM, Copeland PR (2003). "Mechanism and regulation of selenoprotein synthesis". סקירה שנתית של תזונה. 23 (1): 17–40. דוי:10.1146/annurev.nutr.23.011702.073318. PMID 12524431.
- ^ Krzycki JA (December 2005). "The direct genetic encoding of pyrrolysine". חוות דעת נוכחית במיקרוביולוגיה. 8 (6): 706–712. דוי:10.1016/j.mib.2005.10.009. PMID 16256420.
- ^ Théobald-Dietrich A, Giegé R, Rudinger-Thirion J (2005). "Evidence for the existence in mRNAs of a hairpin element responsible for ribosome dependent pyrrolysine insertion into proteins". ביוכימי. 87 (9–10): 813–817. דוי:10.1016/j.biochi.2005.03.006. PMID 16164991.
- ^ Trifonov EN (December 2000). "Consensus temporal order of amino acids and evolution of the triplet code". גֵן. 261 (1): 139–151. דוי:10.1016/S0378-1119(00)00476-5.
- ^ Higgs PG, Pudritz RE (June 2009). "A thermodynamic basis for prebiotic amino acid synthesis and the nature of the first genetic code". אסטרוביולוגיה. 9 (5): 483–90. דוי:10.1089/ast.2008.0280. PMID 19566427.
- ^ Chaliotis A, Vlastaridis P, Mossialos D, Ibba M, Becker HD, Stathopoulos C, Amoutzias GD (February 2017). "The complex evolutionary history of aminoacyl-tRNA synthetases". מחקר על חומצות גרעין. 45 (3): 1059–1068. דוי:10.1093/nar/gkw1182. PMC 5388404. PMID 28180287.
- ^ א ב ג Ntountoumi C, Vlastaridis P, Mossialos D, Stathopoulos C, Iliopoulos I, Promponas V, et al. (נובמבר 2019). "Low complexity regions in the proteins of prokaryotes perform important functional roles and are highly conserved". מחקר על חומצות גרעין. 47 (19): 9998–10009. דוי:10.1093/nar/gkz730. PMC 6821194. PMID 31504783.
- ^ Vermeer C (March 1990). "Gamma-carboxyglutamate-containing proteins and the vitamin K-dependent carboxylase". כתב העת הביוכימי. 266 (3): 625–636. דוי:10.1042/bj2660625. PMC 1131186. PMID 2183788.
- ^ Bhattacharjee A, Bansal M (March 2005). "Collagen structure: the Madras triple helix and the current scenario". חיי IUBMB. 57 (3): 161–172. דוי:10.1080/15216540500090710. PMID 16036578.
- ^ פארק MH (פברואר 2006). "הסינתזה שלאחר התרגום של חומצת אמינו הנגזרת מפוליאמין, היפוזין, בגורם התחלת התרגום האאוקריוטי 5A (eIF5A)". כתב העת לביוכימיה. 139 (2): 161–169. דוי:10.1093 / jb / mvj034. PMC 2494880. PMID 16452303.
- ^ Blenis J, Resh MD (December 1993). "Subcellular localization specified by protein acylation and phosphorylation". חוות דעת נוכחית בביולוגיה של תאים. 5 (6): 984–989. דוי:10.1016/0955-0674(93)90081-Z. PMID 8129952.
- ^ Curis E, Nicolis I, Moinard C, Osowska S, Zerrouk N, Bénazeth S, Cynober L (November 2005). "Almost all about citrulline in mammals". חומצות אמינו. 29 (3): 177–205. דוי:10.1007/s00726-005-0235-4. PMID 16082501. S2CID 23877884.
- ^ Coxon KM, Chakauya E, Ottenhof HH, Whitney HM, Blundell TL, Abell C, Smith AG (August 2005). "Pantothenate biosynthesis in higher plants". עסקאות חברה ביוכימית. 33 (Pt 4): 743–746. דוי:10.1042/BST0330743. PMID 16042590.
- ^ Ketchem RR, Hu W, Cross TA (September 1993). "High-resolution conformation of gramicidin A in a lipid bilayer by solid-state NMR". מַדָע. 261 (5127): 1457–1460. ביבקוד:1993Sci...261.1457K. דוי:10.1126/science.7690158. PMID 7690158.
- ^ Khoury GA, Baliban RC, Floudas CA (ספטמבר 2011). "Proteome-wide post-translational modification statistics: frequency analysis and curation of the swiss-prot database". דוחות מדעיים. 1 (90): 90. ביבקוד:2011NatSR...1E..90K. דוי:10.1038/srep00090. PMC 3201773. PMID 22034591.
- ^ Kryukov GV, Castellano S, Novoselov SV, Lobanov AV, Zehtab O, Guigó R, Gladyshev VN (מאי 2003). "אפיון של סלנו-פרוטומים של יונקים". מַדָע. 300 (5624): 1439–1443. ביבקוד:2003Sci...300.1439K. דוי:10.1126 / science.1083516. PMID 12775843.
- ^ Gromer S, Urig S, Becker K (January 2004). "The thioredoxin system—from science to clinic". סקירות מחקר רפואי. 24 (1): 40–89. דוי:10.1002/med.10051. PMID 14595672.
- ^ Sakami W, Harrington H (1963). "Amino acid metabolism". סקירה שנתית של ביוכימיה. 32 (1): 355–398. דוי:10.1146/annurev.bi.32.070163.002035. PMID 14144484.
- ^ Brosnan JT (April 2000). "Glutamate, at the interface between amino acid and carbohydrate metabolism". כתב העת לתזונה. 130 (4S Suppl.): 988S–990S. דוי:10.1093/jn/130.4.988S. PMID 10736367.
- ^ Young VR, Ajami AM (September 2001). "Glutamine: the emperor or his clothes?". כתב העת לתזונה. 131 (9 Suppl.): 2449S–2459S, 2486S–2487S. דוי:10.1093/jn/131.9.2449S. PMID 11533293.
- ^ צעיר VR (אוגוסט 1994). "Adult amino acid requirements: the case for a major revision in current recommendations". כתב העת לתזונה. 124 (8 Suppl.): 1517S–1523S. דוי:10.1093 / jn / 124.suppl_8.1517S. PMID 8064412.
- ^ Fürst P, Stehle P (June 2004). "What are the essential elements needed for the determination of amino acid requirements in humans?". כתב העת לתזונה. 134 (6 Suppl.): 1558S–1565S. דוי:10.1093/jn/134.6.1558S. PMID 15173430.
- ^ Reeds PJ (July 2000). "חומצות אמינו ניתנות לבלתי-חיוניות לבני אדם". כתב העת לתזונה. 130 (7): 1835S – 1840S. דוי:10.1093 / jn / 130.7.1835S. PMID 10867060.
- ^ Imura K, Okada A (January 1998). "Amino acid metabolism in pediatric patients". תְזוּנָה. 14 (1): 143–148. דוי:10.1016/S0899-9007(97)00230-X. PMID 9437700.
- ^ Lourenço R, Camilo ME (2002). "Taurine: a conditionally essential amino acid in humans? An overview in health and disease". בית חולים נוטריון. 17 (6): 262–270. PMID 12514918.
- ^ Holtcamp W (מרץ 2012). "The emerging science of BMAA: do cyanobacteria contribute to neurodegenerative disease?". פרספקטיבות בריאות סביבתיות. 120 (3): A110–A116. דוי:10.1289/ehp.120-a110. PMC 3295368. PMID 22382274.
- ^ קוקס PA, דייוויס DA, Mash DC, Metcalf JS, Banack SA (ינואר 2016). "Dietary exposure to an environmental toxin triggers neurofibrillary tangles and amyloid deposits in the brain". הליכים: מדעים ביולוגיים. 283 (1823): 20152397. דוי:10.1098/rspb.2015.2397. PMC 4795023. PMID 26791617.
- ^ א ב Brook MS, Wilkinson DJ, Phillips BE, Perez-Schindler J, Philp A, Smith K, Atherton PJ (January 2016). "Skeletal muscle homeostasis and plasticity in youth and ageing: impact of nutrition and exercise". Acta Physiologica. 216 (1): 15–41. דוי:10.1111/apha.12532. PMC 4843955. PMID 26010896.
- ^ Lipton JO, Sahin M (October 2014). "The neurology of mTOR". עֲצָבוֹן. 84 (2): 275–291. דוי:10.1016/j.neuron.2014.09.034. PMC 4223653. PMID 25374355.
Figure 2: The mTOR Signaling Pathway - ^ א ב Phillips SM (May 2014). "A brief review of critical processes in exercise-induced muscular hypertrophy". Sports Medicine. 44 (Suppl. 1): S71–S77. דוי:10.1007/s40279-014-0152-3. PMC 4008813. PMID 24791918.
- ^ ברודלי KJ (מרץ 2010). "ההשפעות של כלי הדם של אמינים עקביים ואמפטמינים". פרמקולוגיה וטיפול. 125 (3): 363–375. דוי:10.1016 / j.pharmthera.2009.11.005. PMID 19948186.
- ^ לינדמן L, Hoener MC (מאי 2005). "רנסנס באמני עקבות בהשראת משפחת GPCR חדשה". מגמות במדעים פרמקולוגיים. 26 (5): 274–281. דוי:10.1016 / j.tips.2005.03.007. PMID 15860375.
- ^ וואנג X, Li J, Dong G, Yue J (פברואר 2014). "המצעים האנדוגניים של CYP2D במוח". כתב העת האירופי לפרמקולוגיה. 724: 211–218. דוי:10.1016 / j.ejphar.2013.12.025. PMID 24374199.
- ^ Savelieva KV, Zhao S, Pogorelov VM, Rajan I, Yang Q, Cullinan E, Lanthorn TH (2008). Bartolomucci A (ed.). "Genetic disruption of both tryptophan hydroxylase genes dramatically reduces serotonin and affects behavior in models sensitive to antidepressants". PLOS ONE. 3 (10): e3301. ביבקוד:2008PLoSO...3.3301S. דוי:10.1371/journal.pone.0003301. PMC 2565062. PMID 18923670.
- ^ Shemin D, Rittenberg D (December 1946). "The biological utilization of glycine for the synthesis of the protoporphyrin of hemoglobin". כתב העת לכימיה ביולוגית. 166 (2): 621–625. PMID 20276176.
- ^ Tejero J, Biswas A, Wang ZQ, Page RC, Haque MM, Hemann C, Zweier JL, Misra S, Stuehr DJ (November 2008). "Stabilization and characterization of a heme-oxy reaction intermediate in inducible nitric-oxide synthase". כתב העת לכימיה ביולוגית. 283 (48): 33498–33507. דוי:10.1074/jbc.M806122200. PMC 2586280. PMID 18815130.
- ^ Rodríguez-Caso C, Montañez R, Cascante M, Sánchez-Jiménez F, Medina MA (August 2006). "Mathematical modeling of polyamine metabolism in mammals". כתב העת לכימיה ביולוגית. 281 (31): 21799–21812. דוי:10.1074/jbc.M602756200. PMID 16709566.
- ^ א ב מייבש שיער L, Berg JM, Tymoczko JL (2002). בִּיוֹכִימִיָה (מהדורה חמישית). ניו יורק: W.H. פרימן. עמ.693–698. ISBN 978-0-7167-4684-3.
- ^ Hylin JW (1969). "Toxic peptides and amino acids in foods and feeds". כתב העת לכימיה חקלאית ומזון. 17 (3): 492–496. דוי:10.1021/jf60163a003.
- ^ Turner BL, Harborne JB (1967). "Distribution of canavanine in the plant kingdom". פיטוכימיה. 6 (6): 863–866. דוי:10.1016/S0031-9422(00)86033-1.
- ^ Ekanayake S, Skog K, Asp NG (May 2007). "Canavanine content in sword beans (Canavalia gladiata): analysis and effect of processing". רעילות מזון וכימיה. 45 (5): 797–803. דוי:10.1016/j.fct.2006.10.030. PMID 17187914.
- ^ Rosenthal GA (2001). "L-Canavanine: a higher plant insecticidal allelochemical". חומצות אמינו. 21 (3): 319–330. דוי:10.1007/s007260170017. PMID 11764412. S2CID 3144019.
- ^ Hammond AC (May 1995). "Leucaena toxicosis and its control in ruminants". כתב העת למדעי בעלי חיים. 73 (5): 1487–1492. דוי:10.2527/1995.7351487x. PMID 7665380.[קישור מת קבוע ]
- ^ א ב Leuchtenberger W, Huthmacher K, Drauz K (November 2005). "Biotechnological production of amino acids and derivatives: current status and prospects". מיקרוביולוגיה שימושית וביוטכנולוגיה. 69 (1): 1–8. דוי:10.1007/s00253-005-0155-y. PMID 16195792. S2CID 24161808.
- ^ Ashmead HD (1993). The Role of Amino Acid Chelates in Animal Nutrition. Westwood: Noyes Publications.
- ^ Garattini S (April 2000). "Glutamic acid, twenty years later". כתב העת לתזונה. 130 (4S Suppl.): 901S–909S. דוי:10.1093/jn/130.4.901S. PMID 10736350.
- ^ Stegink LD (יולי 1987). "סיפור האספרטיים: מודל לבדיקה קלינית של תוסף מזון". כתב העת האמריקאי לתזונה קלינית. 46 (1 Suppl): 204–215. דוי:10.1093 / ajcn / 46.1.204. PMID 3300262.
- ^ Albion Laboratories, Inc. "Albion Ferrochel Website". הוחזר 12 ביולי 2011.
- ^ Ashmead HD (1986). Foliar Feeding of Plants with Amino Acid Chelates. פארק רידג ': פרסומי נויס.
- ^ Turner EH, Loftis JM, Blackwell AD (March 2006). "Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan". פרמקולוגיה וטיפול. 109 (3): 325–338. דוי:10.1016/j.pharmthera.2005.06.004. PMID 16023217.
- ^ Kostrzewa RM, Nowak P, Kostrzewa JP, Kostrzewa RA, Brus R (March 2005). "המוזרויות של ל-DOPA treatment of Parkinson's disease". חומצות אמינו. 28 (2): 157–164. דוי:10.1007/s00726-005-0162-4. PMID 15750845. S2CID 33603501.
- ^ Heby O, Persson L, Rentala M (August 2007). "Targeting the polyamine biosynthetic enzymes: a promising approach to therapy of African sleeping sickness, Chagas' disease, and leishmaniasis". חומצות אמינו. 33 (2): 359–366. דוי:10.1007/s00726-007-0537-9. PMID 17610127. S2CID 26273053.
- ^ Cruz-Vera LR, Magos-Castro MA, Zamora-Romo E, Guarneros G (2004). "Ribosome stalling and peptidyl-tRNA drop-off during translational delay at AGA codons". מחקר על חומצות גרעין. 32 (15): 4462–4468. דוי:10.1093/nar/gkh784. PMC 516057. PMID 15317870.
- ^ Andy C (October 2012). "Molecules 'too dangerous for nature' kill cancer cells". מדען חדש.
- ^ "Lethal DNA tags could keep innocent people out of jail". מדען חדש. 2 במאי 2013.
- ^ Hanessian S (1993). "Reflections on the total synthesis of natural products: Art, craft, logic, and the chiron approach". כימיה טהורה ויישומית. 65 (6): 1189–1204. דוי:10.1351/pac199365061189.
- ^ Blaser HU (1992). "הבריכה הכירלית כמקור לזרזים ועזריים אננטי-סלקטיביים". ביקורות כימיות. 92 (5): 935–952. דוי:10.1021 / cr00013a009.
- ^ Sanda F, Endo T (1999). "Syntheses and functions of polymers based on amino acids". כימיה מקרומולקולרית ופיזיקה. 200 (12): 2651–2661. דוי:10.1002/(SICI)1521-3935(19991201)200:12<2651::AID-MACP2651>3.0.CO;2-P.
- ^ Gross RA, Kalra B (August 2002). "Biodegradable polymers for the environment". מַדָע. 297 (5582): 803–807. ביבקוד:2002Sci...297..803G. דוי:10.1126/science.297.5582.803. PMID 12161646.
- ^ Low KC, Wheeler AP, Koskan LP (1996). Commercial poly(aspartic acid) and Its Uses. Advances in Chemistry Series. 248. וושינגטון.: האגודה האמריקאית לכימיה.
- ^ Thombre SM, Sarwade BD (2005). "Synthesis and Biodegradability of Polyaspartic Acid: A Critical Review". כתב העת למדע מקרומולקולרי, חלק א '. 42 (9): 1299–1315. דוי:10.1080/10601320500189604.
- ^ Bourke SL, Kohn J (April 2003). "Polymers derived from the amino acid ל-tyrosine: polycarbonates, polyarylates and copolymers with poly(ethylene glycol)". ביקורות מתקדמות על מתן תרופות. 55 (4): 447–466. דוי:10.1016/S0169-409X(03)00038-3. PMID 12706045.
- ^ Drauz K, Grayson I, Kleemann A, Krimmer H, Leuchtenberger W, Weckbecker C (2006). האנציקלופדיה לכימיה תעשייתית של אולמן. ויינהיים: ווילי-VCH. דוי:10.1002 / 14356007.a02_057.pub2.
- ^ Jones RC, Buchanan BB, Gruissem W (2000). Biochemistry & molecular biology of plants. Rockville, Md: American Society of Plant Physiologists. עמ.371–372. ISBN 978-0-943088-39-6.
- ^ Brosnan JT, Brosnan ME (June 2006). "The sulfur-containing amino acids: an overview". כתב העת לתזונה. 136 (6 Suppl.): 1636S–1640S. דוי:10.1093/jn/136.6.1636S. PMID 16702333.
- ^ Kivirikko KI, Pihlajaniemi T (1998). "Collagen hydroxylases and the protein disulfide isomerase subunit of prolyl 4-hydroxylases". התקדמות בתחום האנזימולוגיה ובתחומים קשורים בביולוגיה מולקולרית. התקדמות האנזימולוגיה - ואזורים קשורים בביולוגיה מולקולרית. 72. pp. 325–398. דוי:10.1002/9780470123188.ch9. ISBN 9780470123188. PMID 9559057.
- ^ Whitmore L, Wallace BA (May 2004). "Analysis of peptaibol sequence composition: implications for in vivo synthesis and channel formation". כתב העת האירופי לביופיזיקה. 33 (3): 233–237. דוי:10.1007/s00249-003-0348-1. PMID 14534753. S2CID 24638475.
- ^ Alexander L, Grierson D (October 2002). "Ethylene biosynthesis and action in tomato: a model for climacteric fruit ripening". כתב העת לבוטניקה ניסיונית. 53 (377): 2039–2055. דוי:10.1093/jxb/erf072. PMID 12324528.
- ^ Elmore DT, Barrett GC (1998). Amino acids and peptides. קיימברידג ', בריטניה: הוצאת אוניברסיטת קיימברידג'. עמ.48 –60. ISBN 978-0-521-46827-5.
- ^ Gutteridge A, Thornton JM (November 2005). "Understanding nature's catalytic toolkit". מגמות במדעים ביוכימיים. 30 (11): 622–629. דוי:10.1016/j.tibs.2005.09.006. PMID 16214343.
- ^ Ibba M, Söll D (May 2001). "The renaissance of aminoacyl-tRNA synthesis". דוחות EMBO. 2 (5): 382–387. דוי:10.1093/embo-reports/kve095. PMC 1083889. PMID 11375928.
- ^ Lengyel P, Söll D (June 1969). "Mechanism of protein biosynthesis". Bacteriological Reviews. 33 (2): 264–301. דוי:10.1128/MMBR.33.2.264-301.1969. PMC 378322. PMID 4896351.
- ^ Wu G, Fang YZ, Yang S, Lupton JR, Turner ND (March 2004). "Glutathione metabolism and its implications for health". כתב העת לתזונה. 134 (3): 489–492. דוי:10.1093/jn/134.3.489. PMID 14988435.
- ^ Meister A (November 1988). "מטבוליזם של גלוטתיון ושינוי סלקטיבי שלו". כתב העת לכימיה ביולוגית. 263 (33): 17205–17208. PMID 3053703.
- ^ Carpino LA (1992). "1-Hydroxy-7-azabenzotriazole. תוסף צימוד פפטיד יעיל". כתב העת של האגודה האמריקנית לכימיה. 115 (10): 4397–4398. דוי:10.1021 / ja00063a082.
- ^ Marasco D, Perretta G, Sabatella M, Ruvo M (October 2008). "Past and future perspectives of synthetic peptide libraries". מדע החלבון והפפטיד הנוכחי. 9 (5): 447–467. דוי:10.2174/138920308785915209. PMID 18855697.
- ^ Konara S, Gagnona K, Clearfield A, Thompson C, Hartle J, Ericson C, Nelson C (2010). "Structural determination and characterization of copper and zinc bis-glycinates with X-ray crystallography and mass spectrometry". כתב העת לכימיה של תיאום. 63 (19): 3335–3347. דוי:10.1080/00958972.2010.514336.
- ^ Stipanuk MH (2006). Biochemical, physiological, & molecular aspects of human nutrition (מהדורה שנייה). סונדרס אלסבייה.
- ^ Dghaym RD, Dhawan R, Arndtsen BA (September 2001). "The Use of Carbon Monoxide and Imines as Peptide Derivative Synthons: A Facile Palladium-Catalyzed Synthesis of α-Amino Acid Derived Imidazolines". אנג'וונדה כימי. 40 (17): 3228–3230. דוי:10.1002/(SICI)1521-3773(19980703)37:12<1634::AID-ANIE1634>3.0.CO;2-C. PMID 29712039.
- ^ Urry DW (2004). "The change in Gibbs free energy for hydrophobic association: Derivation and evaluation by means of inverse temperature transitions". מכתבים לפיזיקה כימית. 399 (1–3): 177–183. ביבקוד:2004CPL...399..177U. דוי:10.1016/S0009-2614(04)01565-9.
- ^ Marcotte EM, Pellegrini M, Yeates TO, Eisenberg D (אוקטובר 1999). "A census of protein repeats". כתב העת לביולוגיה מולקולרית. 293 (1): 151–60. דוי:10.1006 / jmbi.1999.3136. PMID 10512723.
- ^ Haerty W, Golding GB (October 2010). Bonen L (ed.). "Low-complexity sequences and single amino acid repeats: not just "junk" peptide sequences". גנום. 53 (10): 753–62. דוי:10.1139/G10-063. PMID 20962881.
- ^ Magee T, Seabra MC (April 2005). "Fatty acylation and prenylation of proteins: what's hot in fat". חוות דעת נוכחית בביולוגיה של תאים. 17 (2): 190–196. דוי:10.1016/j.ceb.2005.02.003. PMID 15780596.
- ^ Pilobello KT, Mahal LK (June 2007). "Deciphering the glycocode: the complexity and analytical challenge of glycomics". חוות הדעת הנוכחית בביולוגיה כימית. 11 (3): 300–305. דוי:10.1016/j.cbpa.2007.05.002. PMID 17500024.
- ^ Smotrys JE, Linder ME (2004). "Palmitoylation of intracellular signaling proteins: regulation and function". סקירה שנתית של ביוכימיה. 73 (1): 559–587. דוי:10.1146/annurev.biochem.73.011303.073954. PMID 15189153.
- ^ Kyte J, Doolittle RF (מאי 1982). "שיטה פשוטה להצגת אופי הידרופתי של חלבון". כתב העת לביולוגיה מולקולרית. 157 (1): 105–132. CiteSeerX 10.1.1.458.454. דוי:10.1016/0022-2836(82)90515-0. PMID 7108955.
- ^ Freifelder D (1983). ביוכימיה פיזיקלית (מהדורה שנייה). W. H. Freeman and Company. ISBN 978-0-7167-1315-9.[דף נדרש ]
- ^ Kozlowski LP (January 2017). "Proteome-pאני: proteome isoelectric point database". מחקר על חומצות גרעין. 45 (D1): D1112 – D1116. דוי:10.1093 / nar / gkw978. PMC 5210655. PMID 27789699.
- ^ א ב Hausman RE, Cooper GM (2004). התא: גישה מולקולרית. וושינגטון הבירה: עיתונות ASM. עמ ' 51. ISBN 978-0-87893-214-6.
- ^ Aasland R, Abrams C, Ampe C, Ball LJ, Bedford MT, Cesareni G, Gimona M, Hurley JH, Jarchau T, Lehto VP, Lemmon MA, Linding R, Mayer BJ, Nagai M, Sudol M, Walter U, Winder SJ (פברואר 2002). "נורמליזציה של המינוח למוטיבים של פפטיד כליגנדים של תחומי חלבון מודולריים". מכתבי FEBS. 513 (1): 141–144. דוי:10.1111 / j.1432-1033.1968.tb00350.x. PMID 11911894.
- ^ ועדת IUPAC – IUB למינוח ביוכימי (1972). "סימון בן אות אחת לרצפי חומצות אמינו". כימיה טהורה ויישומית. 31 (4): 641–645. דוי:10.1351 / pac197231040639. PMID 5080161.
- ^ Suchanek M, Radzikowska A, Thiele C (אפריל 2005). "פוטו-לאוצין ופוטו-מתיונין מאפשרים זיהוי של אינטראקציות בין חלבון לתאים חיים".. שיטות טבע. 2 (4): 261–267. דוי:10.1038 / nmeth752. PMID 15782218.
- ^ Muñoz-Huerta RF, Guevara-Gonzalez RG, Contreras-Medina LM, Torres-Pacheco I, Prado-Olivarez J, Ocampo-Velazquez RV (אוגוסט 2013). "סקירת שיטות לחישת מצב החנקן בצמחים: יתרונות, חסרונות והתקדמות אחרונה". חיישנים. באזל, שוויץ. 13 (8): 10823–43. דוי:10.3390 / s130810823. PMC 3812630. PMID 23959242.
- ^ מרטין פ"ד, מאללי DF, מאנינג ג'י, פולר ל '(2002). "קביעת פחמן אורגני וחנקן בקרקע ברמת השדה באמצעות ספקטרוסקופיה כמעט אינפרא אדום". כתב העת הקנדי למדעי הקרקע: 413–422. דוי:10.4141 / S01-054.
לקריאה נוספת
- טימוצ'קו JL (2012). "הרכב ומבנה חלבונים". בִּיוֹכִימִיָה. ניו יורק: וו. ה 'פרימן וחברה. עמ '28–31. ISBN 9781429229364.
- Doolittle RF (1989). "יתירות ברצפי חלבונים". ב- Fasman GD (עורך). חיזויים של מבנה החלבון ועקרונות הקונפורמציה של החלבון. ניו יורק: עיתונות מליאה. עמ '599–623. ISBN 978-0-306-43131-9. LCCN 89008555.
- נלסון DL, קוקס MM (2000). Lehninger עקרונות הביוכימיה (מהדורה שלישית). מו"לים שווים. ISBN 978-1-57259-153-0. LCCN 99049137.
- Meierhenrich U (2008). חומצות אמינו ואסימטריה של החיים (PDF). ברלין: ספרינגר ורלאג. ISBN 978-3-540-76885-2. LCCN 2008930865. הועבר לארכיון מהמקור ב- 12 בינואר 2012.CS1 maint: BOT: לא ידוע על סטטוס ה- url המקורי (קישור)
קישורים חיצוניים
 מדיה הקשורה ל חומצת אמינו ב- Wikimedia Commons
מדיה הקשורה ל חומצת אמינו ב- Wikimedia Commons