 לקליל | |
| שמות | |
|---|---|
| שם IUPAC (2ס) -2,6-חומצה דיאמניוהקסנואית (ל-ליזין) (2ר) -2,6-חומצה דיאמניוהקסנואית (ד-ליזין) | |
| שמות אחרים ליזין, ד-ליזין, ל-ליזין, LYS, h-Lys-OH | |
| מזהים | |
מודל תלת ממדי (JSmol ) |
|
| צ'בי | |
| CHEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.000.673 |
| KEGG | |
PubChem CID | |
| UNII | |
| |
| |
| נכסים | |
| ג6ה14נ2או2 | |
| מסה מולארית | 146.190 g · mol−1 |
| 1.5 ק"ג / ליטר | |
| פַרמָקוֹלוֹגִיָה | |
| B05XB03 (מי) | |
| דף נתונים משלים | |
| מדד שבירה (נ), קבוע דיאלקטרי (εר), וכו. | |
תרמודינמית נתונים | התנהגות שלב גז מוצק – נוזלי |
| UV, IR, NMR, גברת | |
אלא אם צוין אחרת, הנתונים ניתנים לגבי החומרים שלהם מצב סטנדרטי (בטמפרטורה של 25 ° C, 100 kPa). | |
| הפניות לאינפוקס | |
ליזין (סֵמֶל ליס אוֹ ק)[1] הוא חומצת אמינו המשמש בביוסינתזה של חלבונים. הוא מכיל קבוצת α- אמינו (הנמצאת ב פרונטון −NH3+ טופס בתנאים ביולוגיים), קבוצת חומצה α- קרבוקסילית (שנמצאת ב- −COO המופחת− טופס בתנאים ביולוגיים), וליזיל שרשרת צדדית ((CH2)4NH2), ומסווג אותו כ- בסיסי, טעון (ב pH פיזיולוגי), אליפטי חומצת אמינו. זה מוּצפָּן דרך קודונים AAA ו- AAG. כמו כמעט כל חומצות האמינו האחרות, הפחמן α הוא כיראלי וליזין עשוי להתייחס לאחד מהם אננטיומר או א תערובת גזענית של שניהם. לצורך מאמר זה, ליזין יתייחס לאננטיומר L- ליזין הפעיל ביולוגית, כאשר הפחמן α נמצא בתצורת ה- S.
גוף האדם אינו יכול לסנתז ליזין. זה חיוני בבני אדם ויש להשיג אותו מהתזונה. באורגניזמים המסנתזים ליזין יש לו שני עיקרים מסלולים ביוסינתטיים, ה diaminopimelate ו α-aminoadipate מסלולים, המשתמשים במובהק אנזימים ו מצעים ונמצאים באורגניזמים מגוונים. ליזין יְרִידַת חֳמָרִים מתרחש באחד מכמה מסלולים, והשכיח ביותר הוא מסלול סכריאופין.
ליזין ממלאת כמה תפקידים בבני אדם, והכי חשוב פרוטאינוגנזה, אך גם בקישור רוחב של קולגן פוליפפטידים, צריכת חומרים מזינים מינרליים חיוניים, וייצור קרניטין, שהוא המפתח מטבוליזם של חומצות שומן. ליזין מעורב לעתים קרובות גם שינויים בהיסטון, וכך, משפיע על אפיגנום. ה ε קבוצת אמינו משתתפת לעיתים קרובות בקשר מימן וכבסיס כללי ב קָטָלִיזָה. ה- ε-אַמוֹנִיוּם קבוצה (NH3+) מחובר לפחמן הרביעי מהפחמן α, המחובר לקבוצת הקרבוקסיל (C = OOH).[2]
בשל חשיבותו במספר תהליכים ביולוגיים, מחסור בליזין יכול להוביל למספר מצבי מחלה הכוללים רקמות חיבור לקויות, פגיעה בחילוף החומרים של חומצות שומן, אנמיה וחסר אנרגיה בחלבון מערכתית. לעומת זאת, עודף יתר של ליזין, הנגרם על ידי קטבוליזם לא יעיל, עלול לגרום לחמור הפרעות נוירולוגיות.
ליזין בודד לראשונה על ידי הכימאי הביולוגי הגרמני פרדיננד היינריך אדמונד דרכלס בשנת 1889 מהחלבון קזאין בחלב.[3] הוא קרא לזה "ליזין".[4] בשנת 1902, הכימאים הגרמנים אמיל פישר ופריץ ווייגרט קבע את המבנה הכימי של ליזין על ידי סינתזה.[5]
ביוסינתזה

שני מסלולים זוהו בטבע לסינתזה של ליזין. ה מסלול diaminopimelate (DAP) שייך ל אספרטט משפחה ביוסינתטית נגזרת, אשר מעורבת גם בסינתזה של תראונין, מתיונין ו איזולאוצין.[6][7] ואילו מסלול α-aminoadipate (AAA) הוא חלק מה- גלוטמט משפחה ביוסינתטית.[8][9]
מסלול DAP נמצא בשניהם פרוקריוטים ושותל ומתחיל עם דיהידרודיפיקולינאט סינתזה (DHDPS) (E.C 4.3.3.7) מזורז תגובת דחיסה בין האספרטט הנגזר, ל-סמיאלדהיד חלקי, ו פירובט ליצור (4ס) -4-הידרוקסי-2,3,4,5-טטרהידרו- (2ס) חומצה דיקוליקנית (HTPA).[10][11][12][13][14] המוצר הוא אז מוּפחָת על ידי רדוקטאז דיהידרודיפיקולינאט (DHDPR) (E.C 1.3.1.26), עם נאד (פ) ח כתורם פרוטונים, להניב 2,3,4,5-טטרהידרודיפיקולינאט (THDP).[15] מנקודה זו ואילך, נמצאו ארבע וריאציות של מסלולים, כלומר מסלולי האצטילאז, האמינו-טרנספרז, דה-הידרוגנאז והסוצינילאז.[6][16] מסלולי הגרסאות האצטילאזיים והסוצינילאז משתמשים בארבעה אֶנזִים בשלבים מזורזים, מסלול האמינו-טרנספרז משתמש בשני אנזימים, ובמסלול הדהידרוגנאז משתמשים באנזים יחיד.[17] ארבעת המסלולים המשתנים הללו מתכנסים ביצירת המוצר הלפני אחרון, מזודיאמינו-פימלט, אשר לאחר מכן הוא אנזימטי decarboxylated בתגובה בלתי הפיכה שמזרזת על ידי דיקרבוקסילאז diaminopimelate (DAPDC) (E.C 4.1.1.20) לייצר לקליל.[18][19] מסלול ה- DAP מווסת ברמות מרובות, כולל במעלה הזרם באנזימים המעורבים בעיבוד אספרטט וכן בשלב העיבוי המזורז הראשוני של DHDPS.[19][20] ליזין מעניק חזק משוב שלילי לולאה על אנזימים אלה, ובהמשך מווסתת את כל המסלול.[20]
מסלול ה- AAA כרוך בעיבוי של α-ketoglutarate ו אצטיל-CoA באמצעות AAA הביניים לסינתזה של לקליל. הוכח כי מסלול זה קיים בכמה שמרים מינים, כמו גם פרוטיסטים ופטריות גבוהות יותר.[9][21][22][23][24][25][26] עוד דווח כי נמצא גרסה חלופית של מסלול ה- AAA תרמוס תרמופילוס ו פירוקוקוס הוריקושי אשר יכול להצביע על כך שמסלול זה נפוץ יותר בפרוקריוטים ממה שהוצע במקור.[27][28][29] הראשון ו שלב הגבלת קצב במסלול AAA היא תגובת העיבוי בין אצטיל-CoA ל- α-ketoglutarate מזרז על ידי הומוציטרט סינתזה (HCS) (E.C 2.3.3.14) לתת את הומוציטריל-CoA הביניים, כלומר הידרוליזה על ידי אותו אנזים לייצר הומוציטראט.[30] הומוציטרט הוא אנזימטי מְיוֹבָּשׁ על ידי homoaconitase (HAc) (E.C 4.2.1.36) להניב cis-הומאאקונואיט.[31] HAc מזרז תגובה שניה בה cis-הומא-אקונואיט עוברת התייבשות כדי לייצר הומואיסוציטראט.[9] המוצר המתקבל עובר חמצון דקארבוקסילציה על ידי הומואיסוציטראט דהידרוגנאז (HIDH) (E.C 1.1.1.87) להניב α-ketoadipate.[9] AAA נוצר לאחר מכן באמצעות a פירידוקסל 5'-פוספט (PLP) -תלוי אמינו טרנספרז (PLP-AT) (E.C 2.6.1.39), תוך שימוש בגלוטמט כתורם האמינו.[30] מנקודה זו ואילך, מסלול ה- AAA משתנה עם [משהו חסר כאן? -> לכל הפחות, כותרת החלקים! ] על הממלכה. בפטריות, AAA מצטמצם ל- α-aminoadipate-semialdehyde באמצעות AAA reductase (E.C 1.2.1.95) בתהליך ייחודי הכולל שניהם אדנילציה והפחתה שמופעלת על ידי א טרנספז פוספופנטאתיניל (E.C 2.7.8.7).[9] ברגע שנוצר הסמיאלדהיד, סכריאופין רדוקטאז (E.C 1.5.1.10) מזרז תגובה עיבוי עם גלוטמט ו- NAD (P) H, כתורם פרוטון, ואת אני שלי מצטמצם כדי לייצר את המוצר הלפני אחרון, סוכרופין.[29] השלב האחרון של המסלול בפטריות כולל את סוכרופין דהידרוגנאז (SDH) (E.C 1.5.1.8) מזרז חמצון דיאמינציה של סכריאופין, וכתוצאה מכך לקליל.[9] במסלול AAA משתנה המצוי בכמה פרוקריוטים, AAA מומרת לראשונה ל- נAcetyl-α-aminoadipate, כלומר זרחן ואז באופן רדוקטיבי דה-זרחני לאלדהיד ε.[29][30] האלדהיד הוא אז הוחלף ל נאצטיל-ליזין, אשר אינו מוגדר לתת לקליל.[29][30] עם זאת, האנזימים המעורבים במסלול משתנה זה זקוקים לאימות נוסף.
יְרִידַת חֳמָרִים
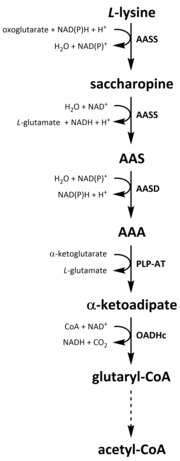
כמו כל חומצות האמינו, יְרִידַת חֳמָרִים ליזין מתחיל מקליטת ליזין תזונתי או מהתמוטטות תאיים חֶלְבּוֹן. קטבוליזם משמש גם כאמצעי לבקרת הריכוז התוך תאי של ליזין חופשי ולשמירה על מצב יציב כדי למנוע את ההשפעות הרעילות של ליזין חופשי מוגזם.[32] ישנם מספר מסלולים המעורבים בקטבוליזם של ליזין, אך הנפוץ ביותר הוא מסלול הסוכרופין, המתרחש בעיקר באזור כָּבֵד (ואיברים מקבילים) בבעלי חיים, במיוחד בתוך מיטוכונדריה.[33][32][34][35] זה ההפוך למסלול AAA שתואר לעיל.[33][36] אצל בעלי חיים וצמחים, שני השלבים הראשונים של מסלול הסוכרופין מזורזים על ידי האנזים הדו-פונקציונלי, α-aminoadipic semialdehyde synthase (AASS), שיש להם גם ליזין-קטוגלוטרט רדוקטאז (LKR) (E.C 1.5.1.8) וגם פעילויות SDH, ואילו באורגניזמים אחרים, כמו חיידקים ופטריות, שני האנזימים הללו מקודדים על ידי גנים.[37][38] הצעד הראשון כולל הפחתה מזרזת LKR של ל-ליזין בנוכחות α-ketoglutarate לייצור סוכרופין, כאשר NAD (P) H משמש כתורם פרוטון.[39] לאחר מכן סוכרופין עובר תגובת התייבשות, מזורזת על ידי SDH בנוכחות נאד+, לייצור AAS וגלוטמט.[40] AAS דהידרוגנאז (AASD) (E.C 1.2.1.31) ואז מייבש את המולקולה ל AAA.[39] לאחר מכן, PLP-AT מזרז את התגובה ההפוכה לזו של מסלול הביוסינתזה של AAA, וכתוצאה מכך המרה AAA ל- α-ketoadipate. המוצר, α-ketoadipate, הוא decarboxylated בנוכחות NAD+ וקואנזים A להניב גלוטריל-CoA, אולם האנזים המעורב בכך עדיין לא יובהר במלואו.[41][42] ישנן עדויות שמצביעות על כך שמתחם 2-oxoadipate dehydrogenase (OADHc), שהוא מבנה הומולוגי ליחידת המשנה E1 של קומפלקס דה-הידרוגנאז אוקסוגלוטרט (OGDHc) (E.C 1.2.4.2), אחראי לתגובת הדקרבוקסילציה.[41][43] לבסוף, glutaryl-CoA הוא decarboxylated חמצון כדי crotony-CoA על ידי glutaryl-CoA dehydrogenase (E.C 1.3.8.6), אשר ממשיך להיות מעובד נוסף באמצעות צעדים אנזימטיים מרובים כדי להניב אצטיל-CoA; פחמן חיוני מטבוליט מעורב מחזור חומצה טריקרבוקסילית (TCA).[39][44][45][46]
ערך תזונתי
ליזין היא אחת מתשע חומצות האמינו החיוניות בבני אדם.[47] דרישות התזונה האנושיות משתנות בין ~ 60 מ"ג · ק"ג−1· ד−1 בינקות ל ~ 30 מ"ג · ק"ג−1· ד−1 אצל מבוגרים.[33] דרישה זו נפוצה בדרך כלל ב חברה מערבית עם הכניסה של ליזין ממקורות בשר וירקות הרבה מעבר לדרישה המומלצת.[33] בתזונה צמחונית, צריכת הליזין פחותה בגלל הכמות המוגבלת של הליזין ב פלח בהשוואה למקורות בשר.[33]
בהתחשב בריכוז המגביל של ליזין בגידולי דגני בוקר, כבר הרבה זמן משערים כי ניתן להגדיל את תכולת הליזין באמצעות שינוי גנטי נוהגים.[48][49] לעתים קרובות שיטות אלה כללו הפרעה בוויסות מכוון של מסלול ה- DAP באמצעות החדרת ליזין שאינו רגיש. אורתולוגים של אנזים DHDPS.[48][49] שיטות אלה זכו להצלחה מוגבלת ככל הנראה בשל רַעִיל תופעות לוואי של ליזין חופשי מוגבר והשפעות עקיפות על מחזור ה- TCA.[50] צמחים צוברים ליזין וחומצות אמינו אחרות בצורת זרע חלבוני אגירה, שנמצא בתוך זרעי הצמח, וזה מייצג את המרכיב המאכל בגידולי הדגנים.[51] זה מדגיש את הצורך לא רק להגדיל ליזין חופשי, אלא גם לכוון ליזין לקראת סינתזה של חלבוני אחסון זרעים יציבים, ובהמשך להגדיל את הערך התזונתי של מרכיב הצריכה של הגידולים.[52][53] אמנם שיטות שינוי גנטי זכו להצלחה מוגבלת, אך מסורתית יותר גידול סלקטיבי טכניקות אפשרו בידוד של "תירס חלבון איכותי ", שהגדילה משמעותית את רמות הליזין טריפטופן, גם חומצת אמינו חיונית. עלייה זו בתכולת הליזין מיוחסת ל- אטום -2 מוטציה שהפחיתה את תַעֲתוּק של חסר ליזין זיין חלבונים לאגירת זרעים הקשורים וכתוצאה מכך הגדילו את שפע החלבונים האחרים העשירים בליזין.[53][54] בדרך כלל, כדי להתגבר על השפע המגביל של ליזין ב בעלי חיים מזון, ליזין המיוצר בתעשייה מתווסף.[55][56] התהליך התעשייתי כולל את תסיסה תרבות של Corynebacterium glutamicum והטיהור שלאחר מכן של ליזין.[55]
מקורות תזונתיים
מקורות טובים לליזין הם מזונות עתירי חלבון כגון ביצים, בשר (במיוחד בשר אדום, טלה, חזיר ועופות), סויה, שעועית ואפונה, גבינה (במיוחד פרמז'ן), ודגים מסוימים (כגון בַּקָלָה ו סרדינים ).[57] ליזין הוא חומצת אמינו מגבילה (חומצת האמינו החיונית המצויה בכמות הקטנה ביותר במזון המסוים) ברובם דגני דגנים, אבל יש בשפע ברובם דופקים (קטניות).[58] דיאטה צמחונית או חלבון מן החי יכולה להיות מספקת לחלבון, כולל ליזין, אם הוא כולל גם דגני דגנים וגם קטניות, אך אין צורך בשתי קבוצות המזון לצרוך באותן ארוחות.
מזון נחשב לבעל ליזין מספיק אם יש בו לפחות 51 מ"ג ליזין לגרם חלבון (כך שהחלבון הוא 5.1% ליזין).[59] L-lysine HCl משמש כ- תוסף תזונה, המספק 80.03% L- ליזין.[60] ככזה, 1 גרם של L- ליזין כלול 1.25 גרם של L- ליזין HCl.
| מזון | ליזין (% חלבון) |
|---|---|
| דג | 9.19% |
| בשר בקר, טחון, 90% רזה / 10% שומן, מבושל | 8.31% |
| עוף, קלייה, בשר ועור, מבושל, קלוי | 8.11% |
| שעועית אזוקי (שעועית אדזוקי), זרעים בוגרים, גולמיים | 7.53% |
| חלב, לא שומן | 7.48% |
| סויה, זרעים בוגרים, גולמיים | 7.42% |
| ביצה, שלם, גולמי | 7.27% |
| אֲפוּנָה, מפוצל, זרעים בוגרים, גולמי | 7.22% |
| עֲדָשָׁה, ורוד, גולמי | 6.97% |
| שעועית, זרעים בוגרים, גולמיים | 6.87% |
| חומוס, (שעועית גרבנזו, גרם בנגלי), זרעים בוגרים, גולמיים | 6.69% |
| שעועית חיל הים, זרעים בוגרים, גולמיים | 5.73% |
תפקידים ביולוגיים
התפקיד הנפוץ ביותר עבור ליזין הוא פרוטאינוגנזה. ליזין ממלא לעתים קרובות תפקיד חשוב ב מבנה חלבון. מאז שרשרת הצד שלה מכילה קבוצה טעונה חיובי בקצה אחד ובארוך הידרופובי זנב פחמן קרוב לעמוד השדרה, הליזין נחשב מעט אמפיפתי. מסיבה זו, ניתן למצוא ליזין קבור כמו גם בתדירות גבוהה יותר בתעלות ממס ובחוץ של חלבונים, שם הוא יכול לתקשר עם הסביבה המימית.[61] ליזין יכול גם לתרום ליציבות חלבון כפי שקבוצת ה- ε- אמינו שלו משתתפת לעיתים קרובות קשירת מימן, גשרי מלח ו קוולנטית אינטראקציות ליצירת א בסיס שיף.[61][62][63][64]
תפקיד מרכזי שני של ליזין נמצא ב אפיגנטיים רגולציה באמצעות היסטון שינוי.[65][66] ישנם מספר סוגים של שינויים היסטוניים קוולנטיים, אשר בדרך כלל כוללים שאריות ליזין שנמצאות בזנב ההיסטונים הבולט. שינויים כוללים לרוב הוספה או הסרה של אצטיל (-CH3שיתוף) יוצר אצטילליזין או לחזור לליזין, עד שלוש מתיל (-CH3), יוביקוויטין או א חלבון סומו קְבוּצָה.[65][67][68][69][70] לשינויים השונים השפעות במורד הזרם על ויסות גנים, בהם ניתן להפעיל או להדחיק גנים.
הליזין הוטמע גם כמילוי תפקיד מפתח בתהליכים ביולוגיים אחרים, כולל; חלבונים מבניים של רקמות חיבור, סִידָן הומאוסטזיס, ו מטבוליזם של חומצות שומן.[71][72][73] הוכח כי ליזין מעורב ב קישור צולב בין השלושה פוליפפטידים סליליים ב קולגן, וכתוצאה מכך יציבותו ועוצמת המתיחה שלו.[71][74] מנגנון זה דומה לתפקיד הליזין קירות תאי חיידקים, בו ליזין (ו מזו-Diaminopimelate) הם קריטיים ליצירת קישורים צולבים, ולכן, ליציבות דופן התא.[75] מושג זה נחקר בעבר כאמצעי לעקוף את השחרור הבלתי רצוי של פוטנציאל מַחֲלִיא חיידקים מהונדסים גנטית. הוצע כי אוקסוטרופי זן של אי קולי (איקס1776) יכול לשמש לכל שיטות השינוי הגנטי, מכיוון שהזן אינו מסוגל לשרוד ללא תוספת של DAP, ולכן אינו יכול לחיות מחוץ לסביבת מעבדה.[76] ליזין הוצע גם להיות מעורב בספיגת מעיים בסידן ובאצירת כליות, ולכן, עשוי לשחק תפקיד ב הומיאוסטזיס של סידן.[72] לבסוף, ליזין הוכח כמבשר קרניטין, המעביר חומצות שומן אל מיטוכונדריה, שם הם יכולים להתחמצן לשחרור אנרגיה.[73][77] קרניטין מסונתז מ טרימתילליזין, שהוא תוצר של השפלה של חלבונים מסוימים, כיוון שיש לשלב תחילה את הליזין בחלבונים ולמתיל אותו לפני שהוסב לקרניטין.[73] עם זאת, אצל יונקים המקור העיקרי לקרניטין הוא באמצעות מקורות תזונתיים, ולא באמצעות המרת ליזין.[73]
ב אופסינים כמו רודופסין והאופינים החזותיים (המקודדים על ידי הגנים OPN1SW, OPN1MW, ו OPN1LW ), רטינדהיד יוצר א בסיס שיף עם שאריות ליזין משומרות, ואינטראקציה של אור עם רטינילין הקבוצה גורמת להעברת אותות ב ראיית צבע (לִרְאוֹת מחזור חזותי לפרטים).
תפקידים שנוי במחלוקת
היה דיון ארוך כי ליזין, כאשר הוא מנוהל תוך ורידי או דרך הפה, יכול להגדיל באופן משמעותי את השחרור של הורמוני גדילה.[78] זה הוביל לכך שספורטאים השתמשו בליזין כאמצעי לקידום צמיחת השרירים בזמן האימון, אולם עד כה לא נמצאו עדויות משמעותיות התומכות ביישום זה של ליזין.[78][79]
כי נגיף הרפס סימפלקס (HSV) חלבונים עשירים יותר בארגינין ודלים בליזין מהתאים שהם מדביקים, תוספי ליזין נוסו כטיפול. מכיוון ששתי חומצות האמינו נלקחות במעי, מושבות מחדש בכליה ומועברות לתאים על ידי אותו הדבר מובילי חומצות אמינו, שפע של ליזין יגביל, בתיאוריה, את כמות הארגינין הזמינה לשכפול נגיפי.[80] מחקרים קליניים אינם מספקים ראיות טובות ליעילות כ מוֹנֵעַ או בטיפול בהתפרצויות HSV.[81][82] בתגובה לטענות המוצר כי ליזין יכול לשפר את התגובות החיסוניות ל- HSV, סקירה של ה- הרשות האירופית לבטיחות מזון לא מצא שום עדות ליחסי סיבה ותוצאה. באותה סקירה, שפורסמה בשנת 2011, לא נמצאו ראיות התומכות בטענות לפיהן הליזין יכול להוריד את הכולסטרול, להגביר את התיאבון, לתרום לסינתזת חלבונים בכל תפקיד שאינו כמזין רגיל, או להגביר את ספיגת או החזקת הסידן.[83]
תפקידים במחלות
מחלות הקשורות בליזין הן תוצאה של עיבוד במורד הזרם של ליזין, כלומר שילובם בחלבונים או שינוי במולקולות אלטרנטיביות. תפקידו של ליזין בקולגן תואר לעיל, עם זאת, מחסור בליזין הידרוקסיליזין המעורב בקישור רוחבי של פפטידים קולגן נקשר למצב מחלה של רקמת החיבור.[84] מכיוון שקרניטין הוא מטבוליט מפתח שמקורו בליזין המעורב בחילוף החומרים של חומצות השומן, תזונה לא תקנית חסרת מספיק קרניטין וליזין עלולה להוביל לירידה ברמות הקרניטין, מה שעלול להשפיע באופן משמעותי על הבריאות של האדם.[77][85] כמו כן הוכח כי ליזין ממלאת תפקיד אֲנֶמִיָה, מכיוון שחשד כי ליזין משפיע על צריכתו של בַּרזֶל ובהמשך, הריכוז של פריטין ב פלזמה בדם.[86] עם זאת, עדיין לא יובהר מנגנון הפעולה המדויק.[86] לרוב, מחסור בליזין נראה בחברות לא מערביות ומתבטא כ תת תזונה של חלבון-אנרגיה, שיש לו השפעות עמוקות ומערכתיות על בריאות הפרט.[87][88] יש גם תוֹרַשְׁתִי מחלה גנטית הכוללת מוטציות באנזימים האחראים לקטבוליזם של ליזין, כלומר אנזים AASS דו-פונקציונלי של מסלול הסוכרופין.[89] בגלל חוסר בקטבוליזם של ליזין, חומצת האמינו מצטברת בפלסמה וחולים מתפתחים היפרליזינמיה, אשר יכול להופיע כאסימפטומטי עד חמור מוגבלות נוירולוגית, כולל אֶפִּילֶפּסִיָה, אטקסיה, ספסטיות, ו פגיעה פסיכו-מוטורית.[89][90] המשמעות הקלינית של היפרליזינמיה הינה נושא לדיון בשטח עם כמה מחקרים שלא מצאו קשר בין מוגבלות פיזית או נפשית לבין היפרליזינמיה.[91] בנוסף לכך, מוטציות בגנים הקשורים לחילוף החומרים בליזין היו מעורבות בכמה מצבי מחלה, כולל אפילפסיה תלויה בפירידוקסין (גן ALDH7A1 ), α-ketoadipic ו- α-aminoadipic aciduria (גן DHTKD1 ), ו חומצה גלוטרית סוג 1 (גן GCDH ).[41][92][93][94][95]
Hyperlysinuria מסומן על ידי כמויות גבוהות של ליזין בשתן.[96] זה לעתים קרובות בגלל א מחלה מטבולית בו א חֶלְבּוֹן מעורב בפירוק הליזין אינו פונקציונלי בגלל מוטציה גנטית.[97] זה עלול להתרחש גם בגלל כישלון של שֶׁל הַכְּלָיוֹת הובלה צינורית.[97]
שימוש בליזין במזון לבעלי חיים
ייצור ליזין למאכל לבעלי חיים הוא תעשייה עולמית גדולה והגיעה בשנת 2009 לכמעט 700,000 טון לפי שווי שוק של מעל 1.22 מיליארד אירו.[98] ליזין הוא תוסף חשוב להאכלת בעלי חיים משום שהוא חומצת אמינו מגבילה כאשר מייעלים את צמיחתם של בעלי חיים מסוימים כגון חזירים ותרנגולות לייצור בשר. תוסף ליזין מאפשר שימוש בחלבון צמחי בעלות נמוכה יותר (למשל תירס ולא סויה ) תוך שמירה על שיעורי צמיחה גבוהים, והגבלת הזיהום מהפרשת חנקן.[99] אולם בתורו, זיהום פוספט הוא עלות סביבתית גדולה כאשר התירס משמש כמזון לעופות ולחזירים.[100]
ליזין מיוצר באופן תעשייתי באמצעות תסיסה מיקרוביאלית, מבסיס בעיקר של סוכר. מחקר ההנדסה הגנטית רודף פעיל אחר זני חיידקים כדי לשפר את יעילות הייצור ולאפשר ייצור ליזין ממצעים אחרים.[98]
בתרבות נפוצה
הסרט משנת 1993 פארק היורה (מבוסס על שנת 1990 מייקל קריכטון רוֹמָן באותו שם ) מאפיינים דינוזאורים שהיו השתנה גנטית כך שלא יכלו לייצר ליזין, דוגמה למהנדסים אוקסטרופיה.[101] זה היה ידוע בכינוי "מצב ליזין" והיה אמור למנוע את משובט דינוזאורים לשרוד מחוץ לפארק, ואילצו אותם להיות תלויים בתוספי ליזין המסופקים על ידי הצוות הווטרינרי בפארק. במציאות, אף בעלי חיים אינם מסוגלים לייצר ליזין (זהו חומצת אמינו חיונית ).[102]
בשנת 1996, הליזין הפך למוקד של מקרה תיקון מחירים, הגדול בתולדות ארצות הברית. ה חברת ארצ'ר דניאלס מידלנד שילמה קנס בסך 100 מיליון דולר, ושלושה ממנהליה הורשעו וקיבלו תקופת מאסר. במקרה של תיקון המחירים נמצאו אשמים גם שתי חברות יפניות (אג'ינומוטו, קיובה האקו) וחברה דרום קוריאנית (סווון).[103] הקלטות וידאו סודיות של הקושרים הקובעים את מחיר הליזין ניתן למצוא באופן מקוון או על ידי בקשת הסרטון ממשרד המשפטים האמריקני, אגף ההגבלים העסקיים. מקרה זה שימש כבסיס הסרט המודיע!, ו ספר באותו הכותרת.[104]
הפניות
![]() מאמר זה הותאם מהמקור הבא תחת א CC BY 4.0 רישיון (2018 ) (דוחות סוקרים ): "ליזין: ביוסינתזה, קטבוליזם ותפקידים" (PDF), WikiJournal למדע, 1 (1): 4, 1 ביוני 2018, דוי:10.15347 / WJS / 2018.004, ISSN 2470-6345, ויקינתונים Q55120301
מאמר זה הותאם מהמקור הבא תחת א CC BY 4.0 רישיון (2018 ) (דוחות סוקרים ): "ליזין: ביוסינתזה, קטבוליזם ותפקידים" (PDF), WikiJournal למדע, 1 (1): 4, 1 ביוני 2018, דוי:10.15347 / WJS / 2018.004, ISSN 2470-6345, ויקינתונים Q55120301
- ^ "הוועדה המשותפת של IUPAC-IUB בנושא המינוח הביוכימי (JCBN). המינוח והסמליות של חומצות אמינו ופפטידים. המלצות 1983". כתב עת ביוכימי. 219 (2): 345–373. 15 באפריל 1984. דוי:10.1042 / bj2190345. PMC 1153490. PMID 6743224.
- ^ ליזין. פרויקט הביולוגיה, המחלקה לביוכימיה וביופיזיקה מולקולרית, אוניברסיטת אריזונה.
- ^ דרכסל ה '(1889). "Zur Kenntniss der Spaltungsprodukte des Caseïns" [[תרומה] לידע [שלנו] אודות מוצרי המחשוף של קזאין]. Journal für Praktische Chemie. סדרה 2 (בגרמנית). 39: 425–429. דוי:10.1002 / prac.18890390135. בעמ ' 428, דרכסל הציג נוסחה אמפירית למלח הכלורופלאטינט של ליזין - C8ה16נ2או2קל2• PtCl4 + H2O - אך מאוחר יותר הוא הודה כי הנוסחה הזו שגויה משום שגבישי המלח הכילו אתנול במקום מים. לִרְאוֹת: דרכסל E (1891). "Der Abbau der Eiweissstoffe" [פירוק חלבונים]. ארכיון לאנטומיה ופיזיולוגיה (בגרמנית): 248–278.; דרכסל ה. "Zur Kenntniss der Spaltungsproducte des Caseïns" [תרומה] לידע [שלנו] על תוצרי המחשוף של קזאין] (בגרמנית): 254–260.
מתוך עמ '. 256:] "... die darin enthaltene Hat hat die Formel C6ה14נ2או2. Der anfängliche Irrthum ist dadurch veranlasst worden, dass das Chloroplatinat nicht, wie angenommen ward, Krystallwasser, sondern Krystallalkohol enthält,… " (... לבסיס [זה] הכלול יש את הנוסחה [האמפירית] C6ה14נ2או2. השגיאה הראשונית נגרמה על ידי הכלורופלטינט שלא מכיל מים בגביש (כפי שהנחו), אלא אתנול ...)
לצטט יומן דורש| יומן =(עֶזרָה) - ^ דרכסל E (1891). "Der Abbau der Eiweissstoffe" [פירוק חלבונים]. ארכיון לאנטומיה ופיזיולוגיה (בגרמנית): 248–278.; פישר E (1891). "Ueber neue Spaltungsproducte des Leimes" [על מוצרי מחשוף חדשים של ג'לטין] (בגרמנית): 465–469.
מתוך עמ '. 469:] "... למות בסיס ג6ה14נ2או2, welche mit dem Namen Lysin bezeichnet werden mag,… " (... הבסיס ג6ה14נ2או2, שעשוי להיות מוגדר בשם "ליזין", ...) [הערה: ארנסט פישר היה סטודנט לתואר שני בדרכסל.]
לצטט יומן דורש| יומן =(עֶזרָה) - ^ פישר E, Weigert F (1902). "Synthese der α, ε - Diaminocapronsäure (פעילים ליזין)" [סינתזה של חומצה α, ε-diaminohexanoic ([אופטי] ליזין לא פעיל)]. Berichte der Deutschen Chemischen Gesellschaft (בגרמנית). 35 (3): 3772–3778. דוי:10.1002 / cber.190203503211.
- ^ א ב הדסון AO, Bless C, Macedo P, Chatterjee SP, Singh BK, Gilvarg C, Leustek T (ינואר 2005). "ביוסינתזה של ליזין בצמחים: עדות למשתנה של מסלולי החיידקים הידועים". Biochimica et Biophysica Acta (BBA) - נושאים כלליים. 1721 (1–3): 27–36. דוי:10.1016 / j.bbagen.2004.09.008. PMID 15652176.
- ^ Velasco AM, Leguina JI, Lazcano A (אוקטובר 2002). "התפתחות מולקולרית של המסלולים הביוסינתטיים של הליזין". כתב העת לאבולוציה מולקולרית. 55 (4): 445–59. דוי:10.1007 / s00239-002-2340-2. PMID 12355264.
- ^ Miyazaki T, Miyazaki J, Yamane H, Nishiyama M (יולי 2004). "אלפא-אמינו-אדיפט אמינו-טרנספרז מחיידק תרמופילי במיוחד, תרמוס תרמופילוס" (PDF). מִיקרוֹבִּיוֹלוֹגִיָה. 150 (נק '7): 2327–34. דוי:10.1099 / mic.0.27037-0. PMID 15256574.
- ^ א ב ג ד ה f שו ה ', אנדי ב', צ'יאן ג'י, מערב אה, קוק PF (2006). "מסלול האלפא-אמינו-אדיפאט לביוסינתזה של ליזין בפטריות". ביוכימיה של תאים וביופיזיקה. 46 (1): 43–64. דוי:10.1385 / CBB: 46: 1: 43. PMID 16943623.
- ^ אטקינסון SC, Dogovski C, Downton MT, Czabotar PE, Dobson RC, Gerrard JA, Wagner J, Perugini MA (מרץ 2013). "חקירה מבנית, קינטית וחישובית של Vitis vinifera DHDPS מגלה תובנה חדשה לגבי מנגנון העיכוב האלוסטרי בתיווך ליזין". ביולוגיה מולקולרית של צמחים. 81 (4–5): 431–46. דוי:10.1007 / s11103-013-0014-7. PMID 23354837.
- ^ Griffin MD, Billakanti JM, Wason A, Keller S, Mertens HD, Atkinson SC, Dobson RC, Perugini MA, Gerrard JA, Pearce FG (2012). "אפיון האנזימים הראשונים המחויבים לביוסינתזה של ליזין ב Arabidopsis thaliana". PLOS ONE. 7 (7): e40318. דוי:10.1371 / journal.pone.0040318. PMC 3390394. PMID 22792278.
- ^ Soares da Costa TP, Muscroft-Taylor AC, Dobson RC, Devenish SR, Jameson GB, Gerrard JA (יולי 2010). "עד כמה חיוני הליזין 'החיוני' באתר הפעיל בסינתזה דיהידרודיפיקולינאט?". ביוכימי. 92 (7): 837–45. דוי:10.1016 / j.biochi.2010.03.004. PMID 20353808.
- ^ Soares da Costa TP, Christensen JB, Desbois S, Gordon SE, Gupta R, Hogan CJ, Nelson TG, Downton MT, Gardhi CK, Abbott BM, Wagner J, Panjikar S, Perugini MA (2015). "ניתוחי מבנה רביעי של אנזים אוליגומרי חיוני". אולטראצנטריפציה אנליטית. שיטות אנזימולוגיה. 562. עמ '205-23. דוי:10.1016 / bs.mie.2015.06.020. ISBN 9780128029084. PMID 26412653.
- ^ Muscroft-Taylor AC, Soares da Costa TP, Gerrard JA (מרץ 2010). "תובנות חדשות לגבי מנגנון הסינתזה של דיהידרודיפיקולינאט באמצעות קלורימטריה טיטרציה איזותרמית". ביוכימי. 92 (3): 254–62. דוי:10.1016 / j.biochi.2009.12.004. PMID 20025926.
- ^ כריסטנסן JB, Soares da Costa TP, Faou P, Pearce FG, Panjikar S, Perugini MA (נובמבר 2016). "מבנה ותפקוד של DHDPS ציאנובקטריאלי ו- DHDPR". דוחות מדעיים. 6 (1): 37111. דוי:10.1038 / srep37111. PMC 5109050. PMID 27845445.
- ^ McCoy AJ, Adams NE, Hudson AO, Gilvarg C, Leustek T, Maurelli AT (נובמבר 2006). "L, L-diaminopimelate aminotransferase, אנזים טרנס-ממלכה המשותף לכלמידיה ולצמחים לסינתזה של דיאמיני-פימלט / ליזין". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 103 (47): 17909–14. דוי:10.1073 / pnas.0608643103. PMC 1693846. PMID 17093042.
- ^ הדסון AO, Gilvarg C, Leustek T (מאי 2008). "אפיון ביוכימי ופילוגנטי של מסלול ביוסינתזה diaminopimelate חדש בפרוקריוטים מזהה צורה שונה של aminotransferase LL-diaminopimelate". כתב העת לבקטריולוגיה. 190 (9): 3256–63. דוי:10.1128 / jb.01381-07. PMC 2347407. PMID 18310350.
- ^ Peverelli MG, Perugini MA (אוגוסט 2015). "Assay משולב אופטימלי לכימות פעילות decarboxylase diaminopimelate". ביוכימי. 115: 78–85. דוי:10.1016 / j.biochi.2015.05.004. PMID 25986217.
- ^ א ב Soares da Costa TP, Desbois S, Dogovski C, Gorman MA, Ketaren NE, Paxman JJ, Siddiqui T, Zammit LM, Abbott BM, Robins-Browne RM, Parker MW, Jameson GB, Hall NE, Panjikar S, Perugini MA (אוגוסט 2016). "קביעת חומרים מבניים המגדירים את העיכוב האלוסטרי של מטרה אנטיביוטית חיונית". מִבְנֶה. 24 (8): 1282–1291. דוי:10.1016 / j.str.2016.05.019. PMID 27427481.
- ^ א ב ג'נדר ג'י, ג'ושי החמישי (1 בינואר 2009). "ביוסינתזה של חומצות אמינו שמקורן באספרטט בערבידופסיס תליאנה". ספר ארבידופסיס. 7: e0121. דוי:10.1199 / tab.0121. PMC 3243338. PMID 22303247.
- ^ אנדי ב ', מערב אה, קוק PF (ספטמבר 2004). "מנגנון קינטי של סינתאז הומוציטרט עם תיוג היסטידין מ- Saccharomyces cerevisiae". בִּיוֹכִימִיָה. 43 (37): 11790–5. דוי:10.1021 / bi048766p. PMID 15362863.
- ^ Bhattacharjee JK (1985). "מסלול אלפא-אמינו-אדיפאט לביוסינתזה של ליזין באיקריוטים תחתונים". ביקורות קריטיות במיקרוביולוגיה. 12 (2): 131–51. דוי:10.3109/10408418509104427. PMID 3928261.
- ^ Bhattacharjee JK, Strassman M (מאי 1967). "הצטברות של חומצות טריקרבוקסיליות הקשורות לביוסינתזה של ליזין במוטציה שמרית". כתב העת לכימיה ביולוגית. 242 (10): 2542–6. PMID 6026248.
- ^ גאילרדין CM, ריבט AM, Heslot H (נובמבר 1982). "צורות פראיות ומוטציות של דה-הידרוזנאז הומואיסוציטרי בשמרים Saccharomycopsis lipolytica". כתב העת האירופי לביוכימיה. 128 (2–3): 489–94. דוי:10.1111 / j.1432-1033.1982.tb06991.x. PMID 6759120.
- ^ WM Jaklitsch, CP Kubicek (יולי 1990). "הומוציטראט סינתאז מ- Penicillium chrysogenum. לוקליזציה, טיהור האיזואנזים הציטוזולי ורגישות לליזין". כתב העת הביוכימי. 269 (1): 247–53. דוי:10.1042 / bj2690247. PMC 1131560. PMID 2115771.
- ^ YE ZH, Bhattacharjee JK (דצמבר 1988). "מסלול ביוסינתזה של ליזין וחוסמים ביוכימיים של ליזין אוקסוטרופים של Schizosaccharomyces pombe". כתב העת לבקטריולוגיה. 170 (12): 5968–70. דוי:10.1128 / jb.170.12.5968-5970.1988. PMC 211717. PMID 3142867.
- ^ Kobashi N, Nishiyama M, Tanokura M (מרץ 1999). "סינתזת ליזין ללא תלות באספרטט בחיידק תרמופילי במיוחד, תרמוס תרמופילוס: ליזין מסונתז באמצעות חומצה אלפא-אמינו-אדיפית ולא באמצעות חומצה דיאמיני-פימלית".. כתב העת לבקטריולוגיה. 181 (6): 1713–8. דוי:10.1128 / JB.181.6.1713-1718.1999. PMC 93567. PMID 10074061.
- ^ Kosuge T, Hoshino T (1999). "מסלול האלפא-אמינו-אדיפאט לביוסינתזה של ליזין מופץ באופן נרחב בקרב זני התרמוס". כתב העת למדעי הביולוגיה וההנדסה הביולוגית. 88 (6): 672–5. דוי:10.1016 / S1389-1723 (00) 87099-1. PMID 16232683.
- ^ א ב ג ד נישידה H, Nishiyama M, Kobashi N, Kosuge T, Hoshino T, Yamane H (דצמבר 1999). "מקבץ גנים פרוקריוטי המעורב בסינתזה של ליזין במסלול האדיפאט האמינו: מפתח להתפתחות הביוסינתזה של חומצות אמיניות". חקר הגנום. 9 (12): 1175–83. דוי:10.1101 / gr.9.12.1175. PMID 10613839.
- ^ א ב ג ד נישידה ה ', נישייאמה מ' (ספטמבר 2000). "מה מאפיין את סינתזת הליזין הפטרייתית בדרך האלפא-אמינו-אדיפטית?". כתב העת לאבולוציה מולקולרית. 51 (3): 299–302. דוי:10.1007 / s002390010091. PMID 11029074.
- ^ Zabriskie TM, ג'קסון MD (פברואר 2000). "ביוסינתזה של ליזין ומטבוליזם בפטריות". דוחות מוצר טבעי. 17 (1): 85–97. דוי:10.1039 / a801345d. PMID 10714900.
- ^ א ב ג'ו X, גלילי G (מאי 2004). "חילוף החומרים של ליזין מווסת במקביל על ידי סינתזה וקטבוליזם ברקמות הרבייה והן ברקמת הצומח".. פיזיולוגיית הצמח. 135 (1): 129–36. דוי:10.1104 / עמ '103.037168. PMC 429340. PMID 15122025.
- ^ א ב ג ד ה Tomé D, Bos C (יוני 2007). "דרישת ליזין דרך מחזור החיים האנושי". כתב העת לתזונה. 137 (6 ספקים 2): 1642S – 1645S. דוי:10.1093 / jn / 137.6.1642S. PMID 17513440.
- ^ Blemings KP, Crenshaw TD, Swick RW, Benevenga NJ (אוגוסט 1994). "ליזין-אלפא-קטוגלוטרט רדוקטאז וסחרופין דהידרוגנאז ממוקמים רק במטריקס המיטוכונדריה בכבד חולדות". כתב העת לתזונה. 124 (8): 1215–21. דוי:10.1093 / jn / 124.8.1215. PMID 8064371.
- ^ גלילי G, טאנג G, Zhu X, Gakiere B (יוני 2001). "קטבוליזם של ליזין: מסלול מטבולי מתח מתפתח ומווסת במיוחד". חוות דעת נוכחית בביולוגיה של צמחים. 4 (3): 261–6. דוי:10.1016 / s1369-5266 (00) 00170-9. PMID 11312138.
- ^ Arruda P, Kemper EL, Papes F, Leite A (אוגוסט 2000). "ויסות קטבוליזם של ליזין בצמחים גבוהים יותר". מגמות במדעי הצומח. 5 (8): 324–30. דוי:10.1016 / s1360-1385 (00) 01688-5. PMID 10908876.
- ^ Saksteder KA, Biery BJ, Morrell JC, Goodman BK, Geisbrecht BV, Cox RP, Gould SJ, Geraghty MT (יוני 2000). "זיהוי הגן הסינתז אלפא-אמינו-אדיפיק סמידהדהיד, הפגום בהיפרליזינמיה משפחתית". כתב העת האמריקאי לגנטיקה אנושית. 66 (6): 1736–43. דוי:10.1086/302919. PMC 1378037. PMID 10775527.
- ^ ג'ו אקס, טאנג ג'י, גלילי ג'י (דצמבר 2002). "פעילות האנזים הדו-פונקציונלי של ארבידופסיס ליזין-קטוגלוטרט רדוקטאז / סוכרופין דהידרוגנאז של קטבוליזם של ליזין מוסדרת על ידי אינטראקציה פונקציונאלית בין שני תחומי האנזים שלו".. כתב העת לכימיה ביולוגית. 277 (51): 49655–61. דוי:10.1074 / jbc.m205466200. PMID 12393892.
- ^ א ב ג Kiyota E, Pena IA, Arruda P (נובמבר 2015). "מסלול הסוכרופין בהתפתחות זרעים ותגובת לחץ של תירס". צמח, תא וסביבה. 38 (11): 2450–61. דוי:10.1111 / pce.12563. PMID 25929294.
- ^ Serrano GC, Rezende e Silva Figueira T, Kiyota E, Zanata N, Arruda P (מרץ 2012). "פירוק ליזין דרך מסלול הסוכרופין בחיידקים: LKR ו- SDH בחיידקים והקשר שלו לאנזימים הצמחיים ובעלי החיים". מכתבי FEBS. 586 (6): 905–11. דוי:10.1016 / j.febslet.2012.02.023. PMID 22449979.
- ^ א ב ג Danhauser K, Sauer SW, Haack TB, Wieland T, Staufner C, Graf E, Zschocke J, Strom TM, Traub T, Okun JG, Meitinger T, Hoffmann GF, Prokisch H, Kölker S (דצמבר 2012). "מוטציות DHTKD1 גורמות ל- 2-aminoadipic ו- 2-oxoadipic aciduria". כתב העת האמריקאי לגנטיקה אנושית. 91 (6): 1082–7. דוי:10.1016 / j.ajhg.2012.10.006. PMC 3516599. PMID 23141293.
- ^ Sauer SW, Opp S, Hoffmann GF, Koeller DM, Okun JG, Kölker S (ינואר 2011). "אפנון טיפולי של מטבוליזם L- ליזין מוחי במודל עכבר לסוכרת גלוטרית מסוג I". מוֹחַ. 134 (נק '1): 157–70. דוי:10.1093 / מוח / awq269. PMID 20923787.
- ^ Goncalves RL, Bunik VI, Brand MD (פברואר 2016). "ייצור של סופר-חמצני / מי חמצן על ידי קומפלקס המיטוכונדריאלי 2-oxoadipate dehydrogenase". ביולוגיה ורפואה רדיקלית בחינם. 91: 247–55. דוי:10.1016 / j.freeradbiomed.2015.12.020. PMID 26708453.
- ^ גו DL, פאטל A, תומאס GH, סלומונס GS, Schor DS, Jakobs C, Geraghty MT (יולי 2002). "אפיון הגן האנושי המקודד אלפא-אמינו-אדיפט אמינו טרנספרז (AADAT)". גנטיקה מולקולרית ומטבוליזם. 76 (3): 172–80. דוי:10.1016 / s1096-7192 (02) 00037-9. PMID 12126930.
- ^ Härtel U, Eckel E, Koch J, Fuchs G, Linder D, Buckel W (1 בפברואר 1993). "טיהור של גלוטריל-CoA דהידרוגנאז מ- Pseudomonas sp., אנזים המעורב בפירוק אנאירובי של בנזואט". ארכיונים של מיקרוביולוגיה. 159 (2): 174–81. דוי:10.1007 / bf00250279. PMID 8439237.
- ^ סאואר SW (אוקטובר 2007). "ביוכימיה וביו-אנרגיות של חסר גלוטריל-CoA דה-הידרוגנאז". כתב העת למחלות מטבוליות תורשתיות. 30 (5): 673–80. דוי:10.1007 / s10545-007-0678-8. PMID 17879145.
- ^ נלסון DL, קוקס MM, Lehninger AL (2013). עקרונות Lehninger של ביוכימיה (מהדורה 6). ניו יורק: W.H. פרימן ופלוגה. ISBN 978-1-4641-0962-1. OCLC 824794893.
- ^ א ב גלילי G, אמיר R (פברואר 2013). "חיזוק צמחים עם חומצות האמינו החיוניות ליזין ומתיונין לשיפור האיכות התזונתית". כתב העת לביוטכנולוגיה של צמחים. 11 (2): 211–22. דוי:10.1111 / pbi.12025. PMID 23279001.
- ^ א ב וואנג ג'י, שו מ ', וואנג וו, גלילי ג'י (יוני 2017). "חיזוק יבול הגננות בחומצות אמינו חיוניות: סקירה". כתב העת הבינלאומי למדעים מולקולריים. 18 (6): 1306. דוי:10.3390 / ijms18061306. PMC 5486127. PMID 28629176.
- ^ Angelovici R, Fait A, Fernie AR, Galili G (ינואר 2011). "תכונת זרעים עם ליזין גבוהה קשורה באופן שלילי למחזור ה- TCA ומאטה את נביטת זרעי Arabidopsis". הפיטולוג החדש. 189 (1): 148–59. דוי:10.1111 / j.1469-8137.2010.03478.x. PMID 20946418.
- ^ אדלמן M, קולט M (2016). "ערך תזונתי של עלה לעומת זרע". גבולות בכימיה. 4: 32. דוי:10.3389 / fchem.2016.00032. PMC 4954856. PMID 27493937.
- ^ ג'יאנג SY, Ma A, Xie L, Ramachandran S (ספטמבר 2016). "שיפור תכולת החלבון ואיכותם על ידי ביטוי יתר של חלבוני היתוך מלאכותיים סינתטיים עם ליזין ותרונין המרכיבים בצמחי אורז". דוחות מדעיים. 6 (1): 34427. דוי:10.1038 / srep34427. PMC 5039639. PMID 27677708.
- ^ א ב יחסי ציבור מטוהרים (נובמבר 2007). "שיפור תכולת החלבון והרכב דגני הדגן". כתב העת למדע דגני בוקר. 46 (3): 239–250. דוי:10.1016 / j.jcs.2007.06.006.
- ^ Prasanna B, Vasal SK, Kassahun B, Singh NN (2001). "תירס חלבון איכותי". מדע עכשווי. 81 (10): 1308–1319. JSTOR 24105845.
- ^ א ב קירשר M, Pfefferle W (אפריל 2001). "ייצור התסיסה של L- ליזין כתוסף מזון לבעלי חיים". כימוספירה. 43 (1): 27–31. דוי:10.1016 / s0045-6535 (00) 00320-9. PMID 11233822.
- ^ Junior L, Alberto L, Letti GV, Soccol CR, Junior L, Alberto L, Letti GV, Soccol CR (2016). "פיתוח סובין מועשר ב- L- ליזין להזנת בעלי חיים באמצעות תסיסה שקועה באמצעות Corynebacterium glutamicum באמצעות מצעים Agroindustrial". ארכיון הביולוגיה והטכנולוגיה הברזילאית. 59. דוי:10.1590/1678-4324-2016150519. ISSN 1516-8913.
- ^ המרכז הרפואי של אוניברסיטת מרילנד. "ליזין". הוחזר 30 בדצמבר 2009.
- ^ צעיר VR, Pellett PL (1994). "חלבונים מהצומח ביחס לתזונה של חלבונים אנושיים וחומצות אמינו". כתב העת האמריקאי לתזונה קלינית. 59 (5 ספקים): 1203S – 1212S. דוי:10.1093 / ajcn / 59.5.1203s. PMID 8172124.
- ^ המכון לרפואה של האקדמיות הלאומיות. "צריכת התייחסות תזונתית למרכיבי תזונה". עמ ' 589. הוחזר 29 באוקטובר 2017.
- ^ "מאגר תוספי תזונה: מידע על תערובת (DSBI)".
L-LYSINE HCL 10000820 80.03% ליזין
- ^ א ב Betts MJ, Russell RB (2003). בארנס MR, גריי IC (עורכים). ביואינפורמטיקה לגנטיקאים. ג'ון ווילי ובניו, בע"מ עמ '289–316. דוי:10.1002 / 0470867302.ch14. ISBN 978-0-470-86730-3.
- ^ Blickling S, Renner C, Laber B, Pohlenz HD, Holak TA, Huber R (ינואר 1997). "מנגנון תגובה של Escherichia coli dihydrodipicolinate synthase שנחקר על ידי גבישי רנטגן וספקטרוסקופיית NMR". בִּיוֹכִימִיָה. 36 (1): 24–33. דוי:10.1021 / bi962272d. PMID 8993314.
- ^ קומאר S, Tsai CJ, Nussinov R (מרץ 2000). "גורמים המשפרים את יציבות החום של החלבון". הנדסת חלבונים. 13 (3): 179–91. דוי:10.1093 / חלבון / 13.3.179. PMID 10775659.
- ^ Sokalingam S, Raghunathan G, Soundrarajan N, Lee SG (9 ביולי 2012). "A study on the effect of surface lysine to arginine mutagenesis on protein stability and structure using green fluorescent protein". PLOS ONE. 7 (7): e40410. דוי:10.1371/journal.pone.0040410. PMC 3392243. PMID 22792305.
- ^ א ב Dambacher S, Hahn M, Schotta G (July 2010). "Epigenetic regulation of development by histone lysine methylation". תוֹרָשָׁה. 105 (1): 24–37. דוי:10.1038/hdy.2010.49. PMID 20442736.
- ^ Martin C, Zhang Y (November 2005). "The diverse functions of histone lysine methylation". ביקורות טבע. ביולוגיה של תאים מולקולריים. 6 (11): 838–49. דוי:10.1038/nrm1761. PMID 16261189.
- ^ Black JC, Van Rechem C, Whetstine JR (November 2012). "Histone lysine methylation dynamics: establishment, regulation, and biological impact". תא מולקולרי. 48 (4): 491–507. דוי:10.1016/j.molcel.2012.11.006. PMC 3861058. PMID 23200123.
- ^ Choudhary C, Kumar C, Gnad F, Nielsen ML, Rehman M, Walther TC, Olsen JV, Mann M (August 2009). "Lysine acetylation targets protein complexes and co-regulates major cellular functions". מַדָע. 325 (5942): 834–40. דוי:10.1126 / science.1175371. PMID 19608861.
- ^ Shiio Y, Eisenman RN (November 2003). "Histone sumoylation is associated with transcriptional repression". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 100 (23): 13225–30. דוי:10.1073/pnas.1735528100. PMC 263760. PMID 14578449.
- ^ Wang H, Wang L, Erdjument-Bromage H, Vidal M, Tempst P, Jones RS, Zhang Y (October 2004). "Role of histone H2A ubiquitination in Polycomb silencing". טֶבַע. 431 (7010): 873–8. דוי:10.1038/nature02985. hdl:10261/73732. PMID 15386022.
- ^ א ב Shoulders MD, Raines RT (2009). "Collagen structure and stability". סקירה שנתית של ביוכימיה. 78: 929–58. דוי:10.1146/annurev.biochem.77.032207.120833. PMC 2846778. PMID 19344236.
- ^ א ב Civitelli R, Villareal DT, Agnusdei D, Nardi P, Avioli LV, Gennari C (1992). "Dietary L-lysine and calcium metabolism in humans". תְזוּנָה. 8 (6): 400–5. PMID 1486246.
- ^ א ב ג ד Vaz FM, Wanders RJ (February 2002). "Carnitine biosynthesis in mammals". כתב העת הביוכימי. 361 (Pt 3): 417–29. דוי:10.1042/bj3610417. PMC 1222323. PMID 11802770.
- ^ Yamauchi M, Sricholpech M (25 May 2012). "Lysine post-translational modifications of collagen". מאמרים בביוכימיה. 52: 113–33. דוי:10.1042/bse0520113. PMC 3499978. PMID 22708567.
- ^ Vollmer W, Blanot D, de Pedro MA (March 2008). "Peptidoglycan structure and architecture". ביקורות מיקרוביולוגיה של FEMS. 32 (2): 149–67. דוי:10.1111/j.1574-6976.2007.00094.x. PMID 18194336.
- ^ Curtiss R (May 1978). "Biological containment and cloning vector transmissibility". כתב העת למחלות זיהומיות. 137 (5): 668–75. דוי:10.1093/infdis/137.5.668. PMID 351084.
- ^ א ב Flanagan JL, Simmons PA, Vehige J, Willcox MD, Garrett Q (April 2010). "Role of carnitine in disease". תזונה ומטבוליזם. 7: 30. דוי:10.1186/1743-7075-7-30. PMC 2861661. PMID 20398344.
- ^ א ב Chromiak JA, Antonio J (2002). "Use of amino acids as growth hormone-releasing agents by athletes". תְזוּנָה. 18 (7–8): 657–61. דוי:10.1016/s0899-9007(02)00807-9. PMID 12093449.
- ^ Corpas E, Blackman MR, Roberson R, Scholfield D, Harman SM (July 1993). "Oral arginine-lysine does not increase growth hormone or insulin-like growth factor-I in old men". כתב העת לגרונטולוגיה. 48 (4): M128–33. דוי:10.1093/geronj/48.4.M128. PMID 8315224.
- ^ Gaby AR (2006). "Natural remedies for Herpes simplex". Altern Med Rev. 11 (2): 93–101. PMID 16813459.
- ^ Tomblin FA, Lucas KH (2001). "Lysine for management of herpes labialis". Am J Health Syst Pharm. 58 (4): 298–300, 304. דוי:10.1093/ajhp/58.4.298. PMID 11225166.
- ^ Chi CC, Wang SH, Delamere FM, Wojnarowska F, Peters MC, Kanjirath PP (7 August 2015). "התערבויות למניעת הרפס סימפלקס לביאליס (פצעים קרים בשפתיים)". מאגר Cochrane של ביקורות שיטתיות (8): CD010095. דוי:10.1002 / 14651858.CD010095.pub2. PMC 6461191. PMID 26252373.
- ^ "Scientific Opinion on the substantiation of health claims related to L-lysine and immune defence against herpes virus (ID 453), maintenance of normal blood LDL-cholesterol concentrations (ID 454, 4669), increase in appetite leading to an increase in energ". יומן EFSA. 9 (4): 2063. 2011. דוי:10.2903/j.efsa.2011.2063. ISSN 1831-4732.
- ^ Pinnell SR, Krane SM, Kenzora JE, Glimcher MJ (May 1972). "A heritable disorder of connective tissue. Hydroxylysine-deficient collagen disease". כתב העת לרפואה של ניו אינגלנד. 286 (19): 1013–20. דוי:10.1056/NEJM197205112861901. PMID 5016372.
- ^ Rudman D, Sewell CW, Ansley JD (September 1977). "Deficiency of carnitine in cachectic cirrhotic patients". כתב העת לחקירה קלינית. 60 (3): 716–23. דוי:10.1172/jci108824. PMC 372417. PMID 893675.
- ^ א ב Rushton DH (July 2002). "Nutritional factors and hair loss". דרמטולוגיה קלינית וניסיונית. 27 (5): 396–404. דוי:10.1046/j.1365-2230.2002.01076.x. PMID 12190640.
- ^ Emery PW (October 2005). "Metabolic changes in malnutrition". עַיִן. 19 (10): 1029–34. דוי:10.1038/sj.eye.6701959. PMID 16304580.
- ^ Ghosh S, Smriga M, Vuvor F, Suri D, Mohammed H, Armah SM, Scrimshaw NS (October 2010). "Effect of lysine supplementation on health and morbidity in subjects belonging to poor peri-urban households in Accra, Ghana". כתב העת האמריקאי לתזונה קלינית. 92 (4): 928–39. דוי:10.3945/ajcn.2009.28834. PMID 20720257.
- ^ א ב Houten SM, Te Brinke H, Denis S, Ruiter JP, Knegt AC, de Klerk JB, Augoustides-Savvopoulou P, Häberle J, Baumgartner MR, Coşkun T, Zschocke J, Sass JO, Poll-The BT, Wanders RJ, Duran M (April 2013). "בסיס גנטי של היפרליזינמיה". אורפנת כתב העת למחלות נדירות. 8: 57. דוי:10.1186/1750-1172-8-57. PMC 3626681. PMID 23570448.
- ^ Hoffmann GF, Kölker S (2016). מחלות מטבוליות מולדות. שפרינגר, ברלין, היידלברג. pp. 333–348. דוי:10.1007/978-3-662-49771-5_22. ISBN 978-3-662-49769-2.
- ^ Dancis J, Hutzler J, Ampola MG, Shih VE, van Gelderen HH, Kirby LT, Woody NC (May 1983). "הפרוגנוזה של היפרליזינמיה: דו"ח ביניים". כתב העת האמריקאי לגנטיקה אנושית. 35 (3): 438–42. PMC 1685659. PMID 6407303.
- ^ Mills PB, Struys E, Jakobs C, Plecko B, Baxter P, Baumgartner M, Willemsen MA, Omran H, Tacke U, Uhlenberg B, Weschke B, Clayton PT (March 2006). "Mutations in antiquitin in individuals with pyridoxine-dependent seizures". רפואה טבעית. 12 (3): 307–9. דוי:10.1038/nm1366. PMID 16491085.
- ^ Mills PB, Footitt EJ, Mills KA, Tuschl K, Aylett S, Varadkar S, Hemingway C, Marlow N, Rennie J, Baxter P, Dulac O, Nabbout R, Craigen WJ, Schmitt B, Feillet F, Christensen E, De Lonlay P, Pike MG, Hughes MI, Struys EA, Jakobs C, Zuberi SM, Clayton PT (July 2010). "Genotypic and phenotypic spectrum of pyridoxine-dependent epilepsy (ALDH7A1 deficiency)". מוֹחַ. 133 (Pt 7): 2148–59. דוי:10.1093/brain/awq143. PMC 2892945. PMID 20554659.
- ^ Hagen J, te Brinke H, Wanders RJ, Knegt AC, Oussoren E, Hoogeboom AJ, Ruijter GJ, Becker D, Schwab KO, Franke I, Duran M, Waterham HR, Sass JO, Houten SM (September 2015). "Genetic basis of alpha-aminoadipic and alpha-ketoadipic aciduria". כתב העת למחלות מטבוליות תורשתיות. 38 (5): 873–9. דוי:10.1007/s10545-015-9841-9. PMID 25860818.
- ^ Hedlund GL, Longo N, Pasquali M (May 2006). "Glutaric acidemia type 1". American Journal of Medical Genetics Part C: Seminars in Medical Genetics. 142 ג (2): 86–94. דוי:10.1002/ajmg.c.30088. PMC 2556991. PMID 16602100.
- ^ "Hyperlysinuria | Define Hyperlysinuria at Dictionary.com".
- ^ א ב Walter, John; John Fernandes; Jean-Marie Saudubray; Georges van den Berghe (2006). Inborn Metabolic Diseases: Diagnosis and Treatment. ברלין: ספרינגר. עמ ' 296. ISBN 978-3-540-28783-4.
- ^ א ב "Norwegian granted for improving lysine production process". All About Feed. 26 בינואר 2010. הועבר לארכיון מ המקורי ב- 11 במרץ 2012.
- ^ Toride Y (2004). "Lysine and other amino acids for feed: production and contribution to protein utilization in animal feeding". Protein sources for the animal feed industry; FAO Expert Consultation and Workshop on Protein Sources for the Animal Feed Industry; Bangkok, 29 April - 3 May 2002. רומא: ארגון המזון והחקלאות של האומות המאוחדות. ISBN 978-92-5-105012-5.
- ^ Abelson PH (March 1999). "A potential phosphate crisis". מַדָע. 283 (5410): 2015. דוי:10.1126/science.283.5410.2015. PMID 10206902.
- ^ Coyne JA (10 October 1999). "The Truth Is Way Out There". הניו יורק טיימס. הוחזר 6 באפריל 2008.
- ^ Wu G (May 2009). "Amino acids: metabolism, functions, and nutrition". חומצות אמינו. 37 (1): 1–17. דוי:10.1007/s00726-009-0269-0. PMID 19301095.
- ^ Connor JM (2008). Global Price Fixing (מהדורה שנייה). היידלברג: ספרינגר-ורלאג. ISBN 978-3-540-78669-6.
- ^ Eichenwald K (2000). The Informant: a true story. ניו יורק: ספרים בברודווי. ISBN 978-0-7679-0326-4.

