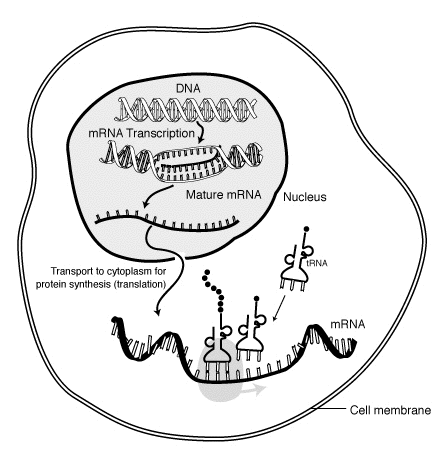
ב ביולוגיה מולקולרית, שליח RNA (mRNA) הוא חד-גדילי מולקולה שֶׁל RNA זה תואם את רצף גנטי של א גֵן, ונקרא על ידי א ריבוזום בתהליך של סינתזה א חֶלְבּוֹן.
בְּמַהֲלָך תַעֲתוּק, RNA פולימראז עושה העתק של גן מה- DNA ל- mRNA לפי הצורך. תהליך זה שונה במקצת אקריוטים ו פרוקריוטים, כולל כי פולימראז RNA פרוקריוטי מתקשר עם אנזימים לעיבוד DNA במהלך תעתיק, כך שהעיבוד יכול להמשיך במהלך השעתוק. לכן זה גורם לגדיל ה- mRNA החדש להפוך סטנדרטים כפולים על ידי ייצור קווצה משלימה המכונה tRNA גָדִיל. בנוסף, ה- RNA אינו מסוגל ליצור מבנים מהתאמת בסיס. יתר על כן, התבנית ל- mRNA היא החוט המשלים של tRNA, וזהה ברצף לרצף האנטי-קודונים שה- DNA נקשר אליו. המוצר קצרת הימים, לא מעובד או מעובד חלקית מכונה מבשר mRNA, או טרום mRNA; לאחר עיבוד מוחלט, הוא מכונה mRNA בוגר.
mRNA נוצר במהלך התהליך של תַעֲתוּק, שם אֶנזִים (RNA פולימראז ) ממיר את הגן ל תמליל ראשוני mRNA (המכונה גם טרום mRNA ). זה לפני ה- mRNA בדרך כלל עדיין מכיל אינטרונים, אזורים שלא ימשיכו לקודד לגמר רצף חומצות אמינו. אלה מוסרים בתהליך שחבור RNA, עוזב בלבד אקסונים, אזורים שיקודדו את החלבון. רצף אקסון זה מהווה mRNA בוגר. ה- mRNA הבוגר נקרא על ידי הריבוזום, ובאמצעותו חומצות אמינו נישא על ידי העברת RNA (tRNA), הריבוזום יוצר את החלבון. תהליך זה מכונה תִרגוּם. כל התהליכים הללו מהווים חלק מה- דוגמה מרכזית של הביולוגיה המולקולרית, המתאר את זרימת המידע הגנטי במערכת ביולוגית.
כמו ב DNA, מידע גנטי ב- mRNA כלול ברצף של נוקלאוטידים, אשר מסודרים לתוך קודונים המורכב משלושה ריבונוקליאוטידים כל אחד. כל קודונים מקודדים עבור ספציפי חומצת אמינו, חוץ מ עצור קודונים, שמפסיקים את סינתזת החלבון. התרגום של קודונים לחומצות אמינו דורש שני סוגים אחרים של RNA: RNA העובר, שמזהה את הקודון ומספק את חומצת האמינו המקבילה, RNA ריבוזומלי (rRNA), המרכיב המרכזי של מכונות ייצור החלבונים של הריבוזום.
קיומו של mRNA הוצע לראשונה על ידי ז'אק מונוד ו פרנסואה ג'ייקוב, והתגלה לאחר מכן על ידי יעקב, סידני ברנר ו מתיו מסלסון ב המכון הטכנולוגי של קליפורניה בשנת 1961.[1]
סינתזה, עיבוד ותפקוד
קיומה הקצר של מולקולת mRNA מתחיל בשעתוק, ובסופו של דבר מסתיים בהשפלה. במהלך חייו, ניתן לעבד, לערוך ולהעביר מולקולת mRNA לפני התרגום. מולקולות mRNA אוקריוטיות דורשות לעיתים קרובות עיבוד והובלה נרחבים, בעוד פרוקריוטי מולקולות mRNA לא. מולקולה של אוקריוטי mRNA והחלבונים המקיפים אותו נקראים יחד a שליח RNP.
תַעֲתוּק
תעתיק הוא כאשר ה- RNA עשוי מ- DNA. במהלך תמלול, RNA פולימראז עושה העתק של גן מה- DNA ל- mRNA לפי הצורך. תהליך זה שונה במקצת באיקריוטים ובפרוקריוטים. הבדל בולט אחד, לעומת זאת, הוא כי פולימראז של RNA פרוקריוטי מתקשר לאנזימים לעיבוד דנ"א במהלך שעתוק, כך שהעיבוד יכול להמשיך במהלך השעתוק. לכן זה גורם לגדיל ה- mRNA החדש להיות כפול תקוע על ידי ייצור קווצה משלימה המכונה גדיל tRNA, אשר כאשר הם משולבים אינם מסוגלים ליצור מבנים מהתאמת בסיס. יתר על כן, התבנית ל- mRNA היא החוט המשלים של tRNA, וזהה ברצף לרצף האנטי-קודונים שה- DNA נקשר אליו. המוצר קצרת הימים, לא מעובד או מעובד חלקית מכונה מבשר mRNA, או טרום mRNA; לאחר עיבוד מוחלט, הוא מכונה mRNA בוגר.
עיבוד טרום mRNA איקריוטי
עיבוד ה- mRNA שונה מאוד בין אקריוטים, בַּקטֶרִיָה, ו ארכאה. MRNA שאינו eukaryotic הוא, למעשה, בוגר עם תמלול ואינו דורש עיבוד, למעט במקרים נדירים.[2] טרום mRNA איקריוטי, לעומת זאת, דורש מספר שלבי עיבוד לפני הובלתו לציטופלזמה ותרגומו על ידי הריבוזום.
שחבור
העיבוד הנרחב של ה- pre-mRNA האוקריוטי המוביל ל- mRNA הבוגר הוא ה- שחבור RNA, מנגנון שבאמצעותו אינטרונים אוֹ מתעלמים (אזורים שאינם מקודדים) מוסרים ו אקסונים (אזורי קידוד) מחוברים יחד.
תוספת מכסה 5 '
א מכסה 5 ' (נקרא גם מכסה RNA, RNA 7-מתילגואנוזין מכסה, או RNA m7כובע G) הוא נוקלאוטיד גואנין שונה שנוסף לחזית או סוף 5 ' של RNA שליח איקריוטי זמן קצר לאחר תחילת התמלול. מכסה 5 'מורכב משאריות 7-מתיל-גואנוזין סופניות המקושרות דרך קשר 5'-5'-טריפוספט אל הנוקלאוטיד הראשון שהועתק. נוכחותו קריטית להכרה על ידי ריבוזום והגנה מפני RNases.
תוספת מכסה משולבת לתעתיק, ומתרחשת בשיתוף תעתיק, כך שכל אחד מהם משפיע על השני. זמן קצר לאחר תחילת התמלול, קצה ה- 5 'של ה- mRNA המסונתז מחויב במתחם מסנתז כובע הקשור ל RNA פולימראז. זֶה אנזימטית מורכב מזרז התגובות הכימיות הנדרשות למכסת mRNA. הסינתזה מתנהלת כרב-שלבים ביוכימי תְגוּבָה.
עֲרִיכָה
במקרים מסוימים, mRNA יהיה עָרוּך, שינוי הרכב הנוקליאוטידים של ה- mRNA הזה. דוגמא בבני אדם היא אפוליפופרוטאין ב mRNA, אשר נערך ברקמות מסוימות, אך לא באחרות. העריכה יוצרת קודון עצירה מוקדם, אשר עם התרגום מייצר חלבון קצר יותר.
פוליאדינליציה
פוליאדינליציה היא קישור קוולנטי של חלק פוליאדיניל למולקולת RNA שליח. באורגניזמים אאוקריוטיים מרבית מולקולות ה- RNA (mRNA) של שליחים מרוכזות בקצה 3 ', אך מחקרים שנעשו לאחרונה הראו שנמצאות גם קטעים קצרים של אורידין (אוליגורידילציה).[3] ה זנב פולי (A) והחלבון הקשור אליו מסייע בהגנה על mRNA מפני השפלה על ידי אקסונוקליזות. פוליאדינליציה חשובה גם לסיום תמלול, לייצוא ה- mRNA מהגרעין ולתרגום. mRNA יכול גם להיות polyadenylated באורגניזמים פרוקריוטיים, כאשר זנבות פולי (A) פועלים כדי להקל, ולא לעכב, השפלה exonucleolytic.
פוליאדינליציה מתרחשת במהלך ו / או מיד לאחר תעתיק ה- DNA ל- RNA. לאחר סיום התעתיק, משרטטים את שרשרת ה- mRNA באמצעות פעולה של קומפלקס אנדונוקליז הקשור ב- RNA פולימראז. לאחר שניתוק ה- mRNA מוסיפים לקצה ה -3 'החופשי באתר המחשוף כ -250 שאריות אדנוזין. תגובה זו מזורזת על ידי פולימראז פוליאנדילאט. בדיוק כמו ב שחבור אלטרנטיבי, יכול להיות יותר מגרסה אחת של polyadenylation של mRNA.
מוטציות של אתר פוליאדינליציה מתרחשות גם כן. תעתיק ה- RNA העיקרי של גן נבקע באתר התוספת poly-A, ו-100-200 A מוסיפים לקצה ה- 3 'של ה- RNA. אם האתר הזה ישתנה, ייווצר מבנה mRNA ארוך ולא יציב באופן חריג.
תַחְבּוּרָה
הבדל נוסף בין אוקריוטים לפרוקריוטים הוא הובלת mRNA. מכיוון שעתוק ותרגום אוקריוטיים מופרדים בתאים, יש לייצא mRNAs איקריוטים מה- גַרעִין אל ה ציטופלזמה - תהליך שעשוי להיות מוסדר במסלולי איתות שונים.[4] MRNAs בוגרים מוכרים על ידי השינויים המעובדים שלהם ואז מיוצאים דרך נקבוביות גרעיניות על ידי קישור לחלבונים המקשרים לכובע CBP20 ו- CBP80,[5] כמו גם מתחם התמלול / יצוא (TREX).[6][7] מסלולי ייצוא mRNA מרובים זוהו באיקריוטים.[8]
בתאים מורכבים במרחב, כמה mRNA מועברים ליעדים תת תאיים מסוימים. בבגרות נוירונים, mRNA מסוימים מועברים מה- סומה ל דנדריטים. אתר אחד של תרגום mRNA נמצא בפוליריבוזומים הממוקמים באופן סלקטיבי מתחת לסינפסות.[9] ה- mRNA עבור Arc / Arg3.1 נגרם על ידי פעילות סינפטית ומתמקם באופן סלקטיבי ליד סינפסות פעילות המבוססות על אותות הנוצרים על ידי קולטני NMDA.[10] MRNAs אחרים עוברים גם לדנדריטים בתגובה לגירויים חיצוניים, כגון mRNA β-actin.[11] עם הייצוא מהגרעין, ה- mRNA של אקטין מתקשר עם ZBP1 ויחידת המשנה 40S. המתחם מאוגד בחלבון מוטורי ומועבר למקום היעד (הארכת נויריט) לאורך השלד. בסופו של דבר ה- ZBP1 זרחן על ידי Src על מנת שיוזם התרגום.[12] בפיתוח נוירונים, mRNAs מועברים גם לאקסונים צומחים ובעיקר קונוסי גדילה. MRNA רבים מסומנים במה שמכונה "מיקודים", שמכוונים את הובלתם למיקום ספציפי.[13]
תִרגוּם
מכיוון ש- mRNA פרוקריוטי לא צריך להיות מעובד או מועבר, תרגום על ידי ה- ריבוזום יכול להתחיל מיד לאחר סיום התמלול. לכן, ניתן לומר שתרגום פרוקריוטי הוא מְצוּמָד לתמלול ומתרחש בתעתיק משותף.
לאחר מכן ניתן לתרגם את ה- mRNA האיקריוטי שעובד והועבר לציטופלזמה (כלומר, mRNA בוגר) על ידי הריבוזום. תרגום עשוי להתרחש בשעה ריבוזומים צף חופשי בציטופלזמה, או מופנה ל רשתית אנדופלזמית דרך חלקיק זיהוי אותות. לכן, שלא כמו בפרוקריוטים, תרגום איקריוטי לא בשילוב ישיר לתמלול.[14] זה אפשרי אפילו בהקשרים מסוימים שרמות ה- mRNA המופחתות מלוות ברמות חלבון מוגברות, כפי שנצפה ברמות ה- mRNA / חלבון של EEF1A1 בסרטן השד.[15]
מִבְנֶה

קידוד אזורים
אזורי קידוד מורכבים מ- קודונים, אשר מפוענחים ומתורגמים לחלבונים על ידי הריבוזום; באיקריוטים בדרך כלל לאחד ובפרוקריוטים בדרך כלל לכמה. אזורי קידוד מתחילים עם התחל קודון ולסיים עם עצור קודון. באופן כללי, קודון ההתחלה הוא שלישיית AUG וקודון העצירה הוא UAG ("ענבר"), UAA ("אוקר") או UGA ("אופל"). אזורי הקידוד נוטים להתייצב על ידי זוגות בסיס פנימיים, דבר זה מונע השפלה.[16][17] בנוסף להיותם קידוד חלבונים, חלקים מאזורי קידוד עשויים לשמש רצפים רגולטוריים ב טרום mRNA כפי ש משפרי שחבור אקסוניים אוֹ משתיקי שחבור אקסוניים.
אזורים לא מתורגמים
אזורים לא מתורגמים (UTR) הם קטעים של ה- mRNA לפני קודון ההתחלה ואחרי קודון העצירה שאינם מתורגמים, מכונים חמישה אזורים לא מתורגמים ראשוניים (5 'UTR) ו- שלושה אזורים ראשונים שלא הועברו (3 'UTR), בהתאמה. אזורים אלה מתועתקים עם אזור הקידוד וכך הם אקסונית כפי שהם נמצאים ב- mRNA הבוגר. מספר תפקידים בביטוי גנים יוחסו לאזורים הלא מתורגמים, כולל יציבות mRNA, לוקליזציה של mRNA ו- יעילות תרגומית. היכולת של UTR לבצע פונקציות אלה תלויה ברצף ה- UTR ויכולה להיות שונה בין ה- mRNAs. וריאנטים גנטיים ב- UTR 3 'היו מעורבים גם ברגישות למחלות בגלל השינוי במבנה ה- RNA ובתרגום החלבון.[18]
ניתן לשלוט על יציבות ה- mRNA על ידי UTR 5 'ו / או 3' בשל זיקה משתנה לאנזימים משפילי RNA הנקראים ריבונוקליזות ולחלבונים נלווים שיכולים לקדם או לעכב את פירוק ה- RNA. (ראה גם, אלמנט יציבות עשיר ב- C.)
יעילות התרגום, לרבות לעיכוב מוחלט של התרגום, יכולה להיות נשלטת על ידי UTR. חלבונים הנקשרים ל- UTR 3 'או 5' עשויים להשפיע על התרגום על ידי השפעה על יכולתו של הריבוזום להיקשר ל- mRNA. MicroRNAs קשור ל 3 'UTR יכול גם להשפיע על יעילות התרגום או על יציבות ה- mRNA.
לוקליזציה ציטופלזמית של mRNA נחשבת לפונקציה של UTR 3 '. ניתן לתרגם שם חלבונים הנחוצים באזור מסוים בתא; במקרה כזה UTR 3 'עשוי להכיל רצפים המאפשרים למקם את התמליל לאזור זה לתרגום.
חלק מהאלמנטים הכלולים באזורים לא מתורגמים מהווים מאפיין מבנה משני כאשר מועתקים ל- RNA. אלמנטים mRNA מבניים אלה מעורבים בוויסות ה- mRNA. חלקם, כגון אלמנט SECIS, הם יעדים לקשירת חלבונים. סוג אחד של אלמנט mRNA, ה- מכשירי ריבו, קושרים ישירות מולקולות קטנות ומשנים את קפלן כדי לשנות את רמות התעתיק או התרגום. במקרים אלה ה- mRNA מווסת את עצמו.
זנב פולי (A)
הזנב 3 'פולי (A) הוא רצף ארוך של אדנין נוקלאוטידים (לרוב כמה מאות) שנוספו ל סוף 3 ' של ה- pre-mRNA. זנב זה מקדם ייצוא מהגרעין ותרגום, ומגן על ה- mRNA מפני השפלה.
מונו-ציסטרוני מול mRNA פוליסטריסטרוני
אומרים כי מולקולת mRNA היא מונוציסטונית כאשר היא מכילה את המידע הגנטי ל לתרגם רק יחיד חֶלְבּוֹן שרשרת (פוליפפטיד). זה המקרה עבור רוב ה אוקריוטי mRNAs.[19][20] מצד שני, mRNA פוליסיסטרוני נושא כמה מסגרות קריאה פתוחות (ORF), שכל אחד מהם מתורגם לפוליפפטיד. לרוב לפוליפפטידים אלו יש פונקציה קשורה (לעתים קרובות הן יחידות המשנה המרכיבות חלבון מורכב סופי) ורצף הקידוד שלהן מקובץ ומווסת יחד באזור רגולציה, המכיל מְקַדֵם ו מַפעִיל. רוב ה- mRNA שנמצא ב בַּקטֶרִיָה ו ארכאה הוא פוליסטרוני,[19] כמו הגנום המיטוכונדריאלי האנושי.[21] MRNA דיסיסטרוני או דו-סיסטוני מקודד רק שניים חלבונים.
מעגלי mRNA
באוקריוטים מולקולות mRNA יוצרות מבנים מעגליים עקב אינטראקציה בין eIF4E ו חלבון מחייב פולי (A), ששניהם נקשרים ל eIF4G, יוצרים גשר mRNA- חלבון- mRNA.[22] סביר כי מעגליזציה מקדמים רכיבה על אופניים של ריבוזומים ב- mRNA המובילים לתרגום יעיל בזמן, ועשויים גם לתפקד כדי להבטיח שתורגמו רק mRNA שלם (ל- mRNA מושפל חלקית באופן אופייני אין מכסה m7G, או ללא זנב פולי-A).[23]
קיימים מנגנונים אחרים למעגל, במיוחד ב- mRNA של נגיף. פוליווירוס mRNA משתמש בקטע תלתן לקצה 5 'שלו כדי לאגד PCBP2, אשר נקשר חלבון מחייב פולי (A), יוצרים את מעגל ה- mRNA-protein-mRNA המוכר. נגיף גמד צהוב שעורה יש קשירה בין מקטעי mRNA בקצה 5 'וקצה 3' (הנקרא לולאות גבעול נשיקות), ומעגל את ה- mRNA ללא חלבונים מעורבים.
גנומים של נגיף RNA (שחוטי + מתורגמים ל- mRNA) מקובלים בדרך כלל.[צורך בציטוט ] במהלך שכפול הגנום המעגל פועל להגברת מהירויות שכפול הגנום, תוך שימוש ברכיבה על אופניים של RNA פולימראז תלוי RNA זהה לזה שהריבוזום משוער למחזור.
הַשׁפָּלָה
ל- mRNAs שונים באותו תא יש חיי חיים שונים (יציבות). בתאי חיידקים, mRNAs בודדים יכולים לשרוד משניות ועד יותר משעה. עם זאת, ממוצע החיים הוא בין 1 ל -3 דקות, מה שהופך את ה- mRNA החיידקי להרבה פחות יציב מאשר ה- mRNA האאוקריוטי.[24] בתאי יונקים, חיי ה- mRNA נעים בין מספר דקות לימים.[25] ככל שהיציבות של mRNA גדולה יותר כך ניתן לייצר יותר חלבון מאותו mRNA. אורך החיים המוגבל של mRNA מאפשר לתא לשנות את סינתזת החלבון במהירות בתגובה לצרכיו המשתנים. ישנם מנגנונים רבים המובילים להרס של mRNA, חלקם מתוארים להלן.
השפלה של mRNA פרוקריוטי
באופן כללי, בפרוקריוטים חיי ה- mRNA קצרים בהרבה מאשר באיקריוטים. פרוקריוטים משפילים את המסרים באמצעות שילוב של ריבונוקליאזות, כולל אנדונוקליזות, אקסונוקליזות 3 'ו- 5' אקסונוקליזות. במקרים מסוימים, מולקולות RNA קטנות (sRNA) עשרות עד מאות נוקליאוטידים יכולים לעורר את ההשפלה של mRNAs ספציפיים על ידי זיווג בסיסים עם רצפים משלימים והקלת מחשוף ריבונוקליז על ידי RNase III. לאחרונה הוכח שגם לחיידקים יש סוג של מכסה 5 ' המורכב מ טריפוספט על סוף 5 '.[26] הסרת שניים מהפוספטים מותירה מונופוספט 5 ', מה שגורם להשמדת המסר על ידי ה- exNuclease RNase J, המדרדר 5' עד 3 '.
מחזור mRNA אוקריוטי
בתוך תאים אוקריוטיים, יש איזון בין תהליכי תִרגוּם וריקבון mRNA. הודעות שמתורגמות באופן פעיל קשורות ל ריבוזומים, ה גורמי חניכה איקריוטיים eIF-4E ו eIF-4G, ו חלבון מחייב פולי (A). eIF-4E ו- eIF-4G חוסמים את אנזים decapping (DCP2 ), וחלבון מחייב פולי (A) חוסם את מורכב אקסוזום, הגנה על קצוות ההודעה. האיזון בין תרגום לריקבון בא לידי ביטוי בגודל ובשפע של מבנים ציטופלזמיים המכונים גופי P[27] ה זנב פולי (A) של ה- mRNA מקוצר על ידי אקסונוקליזות מיוחדות שממוקדות לרנ"א מסנג'ר ספציפי על ידי שילוב של רצפי ויסות-cis על ה- RNA וחלבונים המחייבים RNA. הסרת זנב פולי (A) נחשבת כמשבשת את המבנה המעגלי של המסר ומערערת את היציבות מתחם כריכת כובע. ההודעה נתונה להשפעה על ידי ה- מורכב אקסוזום או ה מתחם decapping. באופן זה, הודעות שאינן פעולות תרגום יכולות להיהרס במהירות, בעוד שהודעות פעילות נשארות על כונן. המנגנון בו נעצר התרגום ומסירת המסר למתחמי ריקבון אינו מובן בפירוט.
ריקבון אלמנטים עשיר ב- AU
הנוכחות של אלמנטים עתירי AU בכמה mRNAs של יונקים נוטה לערער את תמלילי אותם באמצעות פעולת חלבונים תאיים הקושרים רצפים אלה ומגרים פולי (A) הסרת זנב. אובדן הזנב הפולי (A) נחשב לקידום השפלה ב- mRNA על ידי הקלה על ההתקפה של שניהם מורכב אקסוזום[28] וה מתחם decapping.[29] השפלה מהירה ב- mRNA באמצעות אלמנטים עתירי AU הוא מנגנון קריטי למניעת ייצור יתר של ציטוקינים חזקים כגון גורם נמק בגידול (TNF) וגורם מגרה של מושבת גרנולוציטים-מקרופאג (GM-CSF).[30] אלמנטים עשירים ב- AU מווסתים גם את הביוסינתזה של גורמי שעתוק פרוטו-אונקוגניים כמו ג 'יוני ו c-Fos.[31]
ריקבון בתיווך שטויות
הודעות איקריוטיות כפופות למעקב על ידי ריקבון בתיווך שטויות (NMD), אשר בודק את הימצאותם של קודוני עצירה מוקדמים (קודונים שטויות) בהודעה. אלה יכולים לנבוע באמצעות שחבור שלם, רקומבינציה V (D) J בתוך ה מערכת חיסונית אדפטיבית, מוטציות ב- DNA, שגיאות שעתוק, סריקה דולפת על ידי הריבוזום שגורם a שינוי מסגרת, וסיבות אחרות. איתור קודון עצירה בטרם עת מפעיל השפלה של ה- mRNA על ידי פשיטה של 3 ', 3' פולי (A) הסרת זנב, או מחשוף אנדונוקליאוליטי.[32]
RNA מפריע קטן (siRNA)
ב מטאזואנים, RNAים מפריעים קטנים (siRNAs) מעובד על ידי דיסר משולבים במתחם המכונה ה- מתחם השתקה המושרה על ידי RNA או RISC. מתחם זה מכיל endonuclease שמפלח מסרים משלימים לחלוטין אליהם נקשר ה- siRNA. שברי ה- mRNA שנוצרו נהרסים אז על ידי exonucleases. siRNA משמש בדרך כלל במעבדות לחסימת תפקוד הגנים בתרבית התאים. הוא נחשב כחלק ממערכת החיסון המולדת כהגנה מפני נגיפי RNA כפולים.[33]
MicroRNA (miRNA)
MicroRNAs (miRNAs) הם RNAs קטנים שבדרך כלל משלימים חלקית לרצפים ב- RNAs שליחים מטאזואניים.[34] קשירת מירנה להודעה יכולה להדחיק את התרגום של הודעה זו ולהאיץ את הסרת הזנב הפולי (A), ובכך לזרז את השפלת ה- mRNA. מנגנון הפעולה של מירנה הוא נושא למחקר פעיל.[35]
מנגנוני ריקבון אחרים
ישנן דרכים אחרות בהן ניתן לשפץ הודעות, כולל ריקבון ללא הפסקה והשתקה על ידי RNA עם אינטראקציה פיווי (piRNA), בין היתר.
טיפולים מבוססי mRNA
מולקולות mRNA באורך מלא הוצעו כתרופות מאז תחילת עידן הביוטכנולוגיה, אך לא הייתה מתיחה קטנה עד שנות העשרים, אז טיפול מודרני הוקמה והצליחה לגייס כמעט מיליארד דולר במימון סיכון בשלוש השנים הראשונות שלה.[36][37][38][39]
תיאורטית, רצף ה- mRNA המנוהל יכול לגרום לתא לייצר חלבון, שבתורו יכול לטפל ישירות במחלה או יכול לתפקד כ תַרכִּיב; באופן עקיף יותר החלבון יכול להניע אנדוגני תא גזע להבדיל בצורה רצויה.[40][41]
האתגרים העיקריים של הטיפול ב- RNA מתמקדים בהבאת ה- RNA לתאים מכוונים, אפילו יותר מקביעת איזה רצף למסור.[37] רצפי RNA עירומים יתפרקו באופן טבעי לאחר ההכנה; הם עלולים לגרום לגוף מערכת החיסון לתקוף אותם כפולשים; והם בִּלתִי חָדִיר אל ה קרום תא.[41] ברגע שהם נמצאים בתא, עליהם לעזוב את מנגנון ההובלה של התא בכדי לנקוט פעולה בתוך ה- ציטופלזמה, המאכלס את ריבוזומים כי ייצור ישיר של חלבונים.[40]
ראה גם
- שיחות גנים, טכנולוגיית פרופיל mRNA
- מיסרנה mRNA
- תצוגת mRNA
- מעקב mRNA
- תמליל, סכום כל ה- RNA בתא
הפניות
- ^ קוב, מתיו (29 ביוני 2015). "מי גילה את ה- RNA של המסנג'ר?". ביולוגיה נוכחית. 25 (13): R526 – R532. דוי:10.1016 / j.cub.2015.05.032. PMID 26126273. הוחזר 2 ביולי 2020.
- ^ ווטסון, ג'יימס ד '(22 בפברואר 2013). ביולוגיה מולקולרית של הגן, מהדורה 7. פירסון גבוה יותר ארה"ב. ISBN 9780321851499.
- ^ צ'וי ואח '. RNA. 2012. 18: 394–401
- ^ Quaresma AJ, Sievert R, Nickerson JA (אפריל 2013). "ויסות ייצוא mRNA על ידי מסלול התמרת אות PI3 / AKT". ביולוגיה מולקולרית של התא. 24 (8): 1208–1221. דוי:10.1091 / mbc.E12-06-0450. PMC 3623641. PMID 23427269.
- ^ Kierzkowski D, Kmieciak M, Piontek P, Wojtaszek P, Sweikowska-Kulinska Z, Jarmolowski A (ספטמבר 2009). "Arabidopsis CBP20 מכוון למתחם מחייב הכובע לגרעין, והוא מיוצב על ידי CBP80". כתב העת הצמח. 59 (5): 814–825. דוי:10.1111 / j.1365-313X.2009.03915.x. PMID 19453442.
- ^ Strässer K, Masuda S, Mason P, Pfannstiel J, Oppizzi M, Rodriguez-Navarro S, Rondón AG, Aguilera A, Struhl K, Reed R, Hurt E (מאי 2002). "TREX הוא תעתיק צימוד מורכב משומר עם ייצוא RNA שליח". טֶבַע. 417 (6886): 304–308. ביבקוד:2002 טבע 417..304S. דוי:10.1038 / nature746. PMID 11979277. S2CID 1112194.
- ^ Katahira J, Yoneda Y (27 באוקטובר 2014). "תפקידים של מתחם TREX בייצוא גרעיני של mRNA". ביולוגיה של RNA. 6 (2): 149–152. דוי:10.4161 / rna.6.2.8046. PMID 19229134.
- ^ Cenik C, Chua HN, Zhang H, Tarnawsky SP, Akef A, Derti A, Tasan M, מור MJ, Palazzo AF, Roth FP (אפריל 2011). "ניתוח גנום מגלה יחסי גומלין בין אינטרונים 5'UTR לייצוא mRNA גרעיני לגנים הפרשתיים ומיטוכונדריה". PLOS גנטיקה. 7 (4): e1001366. דוי:10.1371 / journal.pgen.1001366. PMC 3077370. PMID 21533221.
- ^ סטיבן O, לוי WB (מרץ 1982). "לוקליזציה מועדפת של פולריבוזומים מתחת לבסיס קוצים דנדריטים בתאי גרגיר של הגירוס המשונן". כתב העת למדעי המוח. 2 (3): 284–291. דוי:10.1523 / JNEUROSCI.02-03-00284.1982. PMC 6564334. PMID 7062109.
- ^ Steward O, Worley PF (אפריל 2001). "מיקוד סלקטיבי של mRNA קשת מסונתז לאחרונה לסינפסות פעילות מחייב הפעלת קולטן NMDA". עֲצָבוֹן. 30 (1): 227–240. דוי:10.1016 / s0896-6273 (01) 00275-6. PMID 11343657. S2CID 13395819.
- ^ איוב ג ', אברוויין ג'יי (דצמבר 2001). "לוקליזציה ותרגום של mRNA בדנדריטים ובאקסונים". ביקורות טבע. מדעי המוח. 2 (12): 889–898. דוי:10.1038/35104069. PMID 11733796. S2CID 5275219.
- ^ ויסות מרחבי של תרגום בטא-אקטין מודגש על ידי זרחון תלוי Src של ZBP1 טבע 04115.
- ^ איינגר K, אבוסה ד ', דיאנה אס, בארי סי, ברברז E, קרסון ג'יי (ספטמבר 1997). "רכיבי תחבורה ולוקליזציה ב- mRNA חלבון בסיסי". כתב העת לביולוגיה של תאים. 138 (5): 1077–1087. דוי:10.1083 / jcb.138.5.1077. PMC 2136761. PMID 9281585.
- ^ סומליה
- ^ Lin CY, Beattie A, Baradaran B, Dray E, Duijf PH (ספטמבר 2018). "MRNA סותר וביטוי חלבוני לא נכון של EEF1A1 בקרצינומה של השד הצינורי עקב ויסות מחזור התא והלחץ התאית". דוחות מדעיים. 8 (1): 13904. ביבקוד:2018 NatSR ... 813904L. דוי:10.1038 / s41598-018-32272-x. PMC 6141510. PMID 30224719.
- ^ שבאלינה SA, Ogurtsov AY, Spiridonov NA (2006). "דפוס תקופתי של מבנה משני mRNA שנוצר על ידי הקוד הגנטי". מחקר על חומצות גרעין. 34 (8): 2428–2437. דוי:10.1093 / nar / gkl287. PMC 1458515. PMID 16682450.
- ^ כץ ל ', ברג' CB (ספטמבר 2003). "בחירה נרחבת למבנה משני של RNA מקומי באזורי קידוד של גנים חיידקיים". חקר הגנום. 13 (9): 2042–2051. דוי:10.1101 / gr.1257503. PMC 403678. PMID 12952875.
- ^ Lu YF, Mouger DM, Goldstein DB, Urban TJ, Weeks KM, Bradrick SS (נובמבר 2015). "מבנה ה- mRNA של IFNL3 משופץ על ידי פולימורפיזם פונקציונלי שאינו מקודד הקשור לאישור וירוס הפטיטיס C". דוחות מדעיים. 5: 16037. ביבקוד:2015 NatSR ... 516037L. דוי:10.1038 / srep16037. PMC 4631997. PMID 26531896.
- ^ א ב קוזאק מ '(מרץ 1983). "השוואה בין התחלת סינתזת חלבונים בפרוקריוטים, אוקריוטים ואברונים". ביקורות מיקרוביולוגיות. 47 (1): 1–45. דוי:10.1128 / MMBR.47.1.1-45.1983. PMC 281560. PMID 6343825.
- ^ Niehrs C, Pollet N (דצמבר 1999). "קבוצות סינקשן ביטוי באיקריוטים". טֶבַע. 402 (6761): 483–487. ביבקוד:1999 טבע.402..483 ן. דוי:10.1038/990025. PMID 10591207. S2CID 4349134.
- ^ Mercer TR, Neph S, Dinger ME, Crawford J, Smith MA, Shearwood AM, Haugen E, Bracken CP, Rackham O, Stamatoyannopoulos JA, פיליפובסקה A, Mattick JS (אוגוסט 2011). "תעתיק המיטוכונדריה האנושי". תָא. 146 (4): 645–658. דוי:10.1016 / j.cell.2011.06.051. PMC 3160626. PMID 21854988.
- ^ וולס SE, הילנר PE, Vale RD, זאקס AB (יולי 1998). "מעגול mRNA על ידי גורמי ייזום תרגום אוקריוטים" (w). תא מולקולרי. 2 (1): 135–140. דוי:10.1016 / S1097-2765 (00) 80122-7. PMID 9702200.
- ^ לופז-לסטרה M, ריבאס A, Barría MI (2005). "סינתזת חלבונים באאוקריוטים: הרלוונטיות הביולוגית ההולכת וגוברת של התחלת תרגום בלתי תלויה בכובע". מחקר ביולוגי. 38 (2–3): 121–146. דוי:10.4067 / S0716-97602005000200003. PMID 16238092.
- ^ הגנים של לוין X. לוין, בנג'מין. קרבס, ג'וסלין א ', קילפטריק, סטיבן ט., גולדשטיין, אליוט ס., לוין, בנג'מין. (מהדורה 10). סודברי, מיסה: ג'ונס וברטלט. 2011. ISBN 9780763766320. OCLC 456641931.CS1 maint: אחרים (קישור)
- ^ יו ג'יי, ראסל ג'יי (ספטמבר 2001). "ניתוח מבני ופונקציונלי של קומפלקס mRNP המתווך ביציבות הגבוהה של mRNA בטא-גלובין אנושי". ביולוגיה מולקולרית ותאית. 21 (17): 5879–5888. דוי:10.1128 / mcb.21.17.5879-5888.2001. PMC 87307. PMID 11486027.
- ^ דיאנה A, Celesnik H, Belasco JG (ינואר 2008). "האנזים החיידקי RppH מעורר פירוק RNA של שליח על ידי הסרת פירופוספט 5 '". טֶבַע. 451 (7176): 355–358. ביבקוד:2008 טבע 451..355 ד. דוי:10.1038 / nature06475. PMID 18202662. S2CID 4321451.
- ^ פארקר R, שת U (מרץ 2007). "גופי P ושליטה בתרגום והשפלה של mRNA". תא מולקולרי. 25 (5): 635–646. דוי:10.1016 / j.molcel.2007.02.011. PMID 17349952.
- ^ Chen CY, Gherzi R, Ong SE, Chan EL, Raijmakers R, Pruijn GJ, Stoecklin G, Moroni C, Mann M, Karin M (נובמבר 2001). "חלבונים מחייבים AU מגייסים את האקסוזום להשפלת mRNAs המכילים ARE". תָא. 107 (4): 451–464. דוי:10.1016 / S0092-8674 (01) 00578-5. PMID 11719186. S2CID 14817671. הועבר לארכיון מ המקורי בתאריך 17/09/2011. הוחזר 2009-02-01.
- ^ Fenger-Grøn M, Fillman C, Norrild B, Lykke-Andersen J (דצמבר 2005). "גורמי גוף מרובים בעיבוד וחלבון ה- TTP המחייב ARE מפעילים decapping mRNA" (PDF). תא מולקולרי. 20 (6): 905–915. דוי:10.1016 / j.molcel.2005.10.031. PMID 16364915. הועבר לארכיון מ המקורי (PDF) בתאריך 06-06-2011.
- ^ שו G, Kamen R (אוגוסט 1986). "רצף AU שמור מהאזור הלא מתורגם '3 של GM-CSF mRNA מתווך פירוק mRNA סלקטיבי". תָא. 46 (5): 659–667. דוי:10.1016/0092-8674(86)90341-7. PMID 3488815. S2CID 40332253.
- ^ Chen CY, Shyu AB (נובמבר 1995). "אלמנטים עשירים ב- AU: אפיון וחשיבות בהשפלת ה- mRNA". מגמות במדעים ביוכימיים. 20 (11): 465–470. דוי:10.1016 / S0968-0004 (00) 89102-1. PMID 8578590.
- ^ Isken O, Maquat LE (אוגוסט 2007). "בקרת איכות של mRNA eukaryotic: שמירה על תאים מפני תפקוד mRNA לא תקין". גנים ופיתוח. 21 (15): 1833–1856. דוי:10.1101 / gad.1566807. PMID 17671086.
- ^ תקליטן אובארד, גורדון KH, באק AH, ג'יג'ינס FM (ינואר 2009). "התפתחות ה- RNAi כהגנה מפני וירוסים ואלמנטים הניתנים להעברה". עסקאות פילוסופיות של החברה המלכותית בלונדון. סדרה ב ', מדעים ביולוגיים. 364 (1513): 99–115. דוי:10.1098 / rstb.2008.0168. PMC 2592633. PMID 18926973.
- ^ ברנקי ג'יי, סטארק A, ראסל RB, כהן SM (מרץ 2005). "עקרונות של זיהוי יעד של מיקרו-רנ"א". ביולוגיה של PLOS. 3 (3): e85. דוי:10.1371 / journal.pbio.0030085. PMC 1043860. PMID 15723116.
- ^ Eulalio A, Huntzinger E, Nishihara T, Rewwinkel J, Fauser M, Izaurralde E (ינואר 2009). "דדנילציה היא השפעה נרחבת של ויסות מירנה". RNA. 15 (1): 21–32. דוי:10.1261 / rna.1399509. PMC 2612776. PMID 19029310.
- ^ גרגורי הואנג (6 בדצמבר 2012). "Moderna, 40 מיליון דולר בגרירה, מקווה להמציא מחדש את הביוטכנולוגיה עם" הכינו סם משלכם"". אקסונומיה.
- ^ א ב קצ'מרק JC, קובלסקי נ.ב., אנדרסון DG (יוני 2017). "התקדמות במסירת טיפולי RNA: ממושג למציאות קלינית". רפואה של הגנום. 9 (1): 60. דוי:10.1186 / s13073-017-0450-0. PMC 5485616. PMID 28655327.
- ^ עורב D (7 בספטמבר 2017). "ההתחייבות של Moderna מגדירה את מירוץ המשקיעים למשקיעים; קבוצת ביוטק מבטיחה לשכתב את כללי פיתוח התרופות - אם כי הספקנים טוענים כי הערכת שווי של 5 מיליארד דולר אינה ראויה". זמנים כלכליים.
- ^ אדמס ב '(14 בספטמבר 2017). "Moderna משנה את מודל המו"פ, מפרסם סרטן, עדכוני ניסויי קורות חיים". FierceBiotech.
- ^ א ב חג'ג 'KA, ווייטהד KA (12 בספטמבר 2017). "כלים לתרגום: חומרים לא ויראליים למסירת mRNA טיפולית". טבע ביקורות חומרים. 2 (10): 17056. ביבקוד:2017NatRM ... 217056H. דוי:10.1038 / natrevmats.2017.56.
- ^ א ב גוסיינוב E, Kozlov M, Scanlan C (15 בספטמבר 2015). "טיפולים וחיסונים מבוססי RNA". חדשות הנדסה גנטית.
לקריאה נוספת
- Alsaweed M, Lai CT, Hartmann PE, Geddes DT, Kakulas F (פברואר 2016). "מירנות חלב אנוש מקורן בעיקר בבלוטת החלב וכתוצאה מכך פרופילי מירנה ייחודיים של חלב מפוצל". דוחות מדעיים. 6 (1): 20680. ביבקוד:2016 NatSR ... 620680A. דוי:10.1038 / srep20680. PMC 4745068. PMID 26854194.
- Lillycrop KA, Burdge GC (אוקטובר 2012). "מנגנונים אפיגנטיים המקשרים בין תזונה מוקדמת לבריאות לטווח הארוך". שיטות עבודה מומלצות ומחקר. אנדוקרינולוגיה קלינית ומטבוליזם. 26 (5): 667–676. דוי:10.1016 / j.beem.2012.03.009. PMID 22980048.
- מלניק לפני הספירה, Kakulas F, Geddes DT, Hartmann PE, John SM, Carrera-Bastos P, Cordain L, Schmitz G (21 ביוני 2016). "מירנות חלב: חומרים מזינים פשוטים או מווסתים פונקציונליים מערכתיים?". תזונה ומטבוליזם. 13 (1): 42. דוי:10.1186 / s12986-016-0101-2. PMC 4915038. PMID 27330539.
- ויקרס MH (יוני 2014). "תזונה מוקדמת לחיים, אפיגנטיקה ותכנות של מחלות חיים מאוחרות יותר". חומרים מזינים. 6 (6): 2165–2178. דוי:10.3390 / nu6062165. PMC 4073141. PMID 24892374.
- ג'ואו Q, Li M, וואנג X, Li Q, וואנג T, ג'ו קיו, ג'ואו X, וואנג X, גאו X, Li X (2012). "מיקרו-רנ"א הקשורים לחיסון נמצאים בשפע באקסוזומים מחלב אם". כתב העת הבינלאומי למדעי הביולוגיה. 8 (1): 118–123. דוי:10.7150 / ijbs.8.118. PMC 3248653. PMID 22211110.
קישורים חיצוניים
- חיי ה- mRNA אנימציית פלאש
- אטלס RNAi: מאגר של ספריות RNAi ותוצאות ניתוח היעד שלהן
- miRSearch: כלי למציאת מיקרו-רנ"א הממוקדות ל- mRNA
- כיצד מקודדים mRNA?: סרטון יוטיוב
[1]: מאמר חדשות