מאמר זה עשוי לִדרוֹשׁ לנקות לפגוש את ויקיפדיה סטנדרטים של איכות. הבעיה הספציפית היא: חתוך את החלק של המוטציה הסומטית מכיוון שפרטים יכולים להיות במאמר משלו (ספטמבר 2020) (למד כיצד ומתי להסיר הודעת תבנית זו) |
| חלק מ סדרה עַל |
| גנטיקה |
|---|
 |
| מרכיבי מפתח |
| היסטוריה ונושאים |
| מחקר |
| רפואה מותאמת אישית |
| רפואה מותאמת אישית |

ב ביולוגיה, א מוּטָצִיָה הוא שינוי ב- רצף נוקלאוטידים של ה גנום של אורגניזם, נגיף, או DNA חוץ-כרומוזומלי.[1] גנום נגיפי מכיל את אחד מהם DNA אוֹ RNA. מוטציות נובעות משגיאות במהלך DNA אוֹ שכפול ויראלי, מיטוזה, או מיוזה או סוגים אחרים של נֵזֶק ל- DNA (כגון דימירים פירימידינים נגרמת מחשיפה ל אוּלְטרָה סָגוֹל קרינה), שעשויה לעבור תיקון מועד לטעות (במיוחד הצטרפות לסוף בתיווך מיקרו-הומולוגיה[2]), לגרום לשגיאה במהלך צורות תיקון אחרות,[3][4] או לגרום לשגיאה במהלך השכפול (סינתזת מעבר ). מוטציות עשויות לנבוע גם מ הַכנָסָה אוֹ מְחִיקָה מקטעי DNA עקב יסודות גנטיים ניידים.[5][6][7]
מוטציות עשויות לחולל שינויים ניכרים במאפיינים הניתנים לצפייה (או שלא).פנוטיפ ) של אורגניזם. מוטציות ממלאות חלק בתהליכים ביולוגיים נורמליים ובלתי תקינים, כולל: אבולוציה, מחלת הסרטן, והתפתחות ה - מערכת החיסון, כולל גיוון צומת. מוטציה היא המקור האולטימטיבי לכולם וריאציה גנטית, המספק את חומר הגלם עליו יכולים לפעול כוחות אבולוציוניים כגון הברירה הטבעית.
מוטציה יכולה לגרום לסוגים רבים ושונים של שינוי ברצפים. מוטציות ב גנים לא יכולה להשפיע, לשנות את תוצר של גן, או למנוע מהגן לתפקד כראוי או לחלוטין. מוטציות יכולות להתרחש גם ב אזורים נוגניים. מחקר שנערך בשנת 2007 על וריאציות גנטיות בין שונה מִין שֶׁל דרוזופילה הציע שאם מוטציה תשנה א חֶלְבּוֹן מיוצר על ידי גן, התוצאה עשויה להזיק, עם הערכה של 70% מ חומצת אמינו פולימורפיזמים שיש להם השפעות מזיקות, והיתר נייטרלי או מועיל בשוליים.[8] בשל ההשפעות המזיקות שיכולות להיות למוטציות על גנים, יש לאורגניזמים מנגנונים כגון תיקון DNA כדי למנוע או לתקן מוטציות על ידי החזרת הרצף המוטציה למצב המקורי שלו.[5]
סקירה כללית
מוטציות יכולות לכלול את שִׁכפוּל של חלקים גדולים של DNA, בדרך כלל דרך רקומבינציה גנטית.[9] כפילויות אלה מהוות מקור עיקרי לחומר גלם להתפתחות גנים חדשים, כאשר עשרות עד מאות גנים משוכפלים בגנום של בעלי חיים מדי מיליון שנה.[10] רוב הגנים שייכים לגדולים יותר משפחות גנים ממוצא משותף, הניתן לזיהוי על ידי שלהם הומולוגיית רצף.[11] גנים חדשניים מיוצרים בכמה שיטות, בדרך כלל באמצעות שכפול ומוטציה של גן אבות, או על ידי שילוב מחדש של חלקים בגנים שונים ליצירת שילובים חדשים עם פונקציות חדשות.[12][13]
כאן, תחומי חלבון לשמש כמודולים, כל אחד עם פונקציה מסוימת ועצמאית, שניתן לערבב יחד כדי לייצר גנים המקודדים חלבונים חדשים בעלי תכונות חדשניות.[14] לדוגמא, ה בן אנוש העין משתמשת בארבעה גנים כדי ליצור מבנים שחשים אור: שלושה עבור תא חרוט אוֹ ראיית צבע ואחד ל תא מוט או ראיית לילה; כל הארבע נבעו מגן אבות יחיד.[15] יתרון נוסף בשכפול גן (או אפילו גנום שלם) הוא שהדבר גדל יתירות הנדסית; זה מאפשר לגן אחד בזוג לרכוש פונקציה חדשה ואילו העותק השני מבצע את הפונקציה המקורית.[16][17] סוגים אחרים של מוטציות יוצרים מדי פעם גנים חדשים מבעבר DNA שאינו מקודד.[18][19]
שינויים ב כרומוזום המספר עשוי להיות כרוך במוטציות גדולות עוד יותר, כאשר קטעי ה- DNA בתוך הכרומוזומים נשברים ואז מסודרים מחדש. לדוגמא, ב הומינינה, שני כרומוזומים התמזגו לייצור אנושי כרומוזום 2; היתוך זה לא התרחש ב יוּחֲסִין של האחר קופים והם שומרים על כרומוזומים נפרדים אלה.[20] באבולוציה, התפקיד החשוב ביותר של סידורים מחדש כרומוזומליים כאלה עשוי להיות להאיץ את התפשטות האוכלוסייה מינים חדשים על ידי הפיכתן של פחות אוכלוסיות לאוכלוסיות שונות, ובכך לשמר הבדלים גנטיים בין אוכלוסיות אלה.[21]
רצפי DNA שיכולים לנוע סביב הגנום, כגון transposons, מהווים חלק עיקרי מהחומר הגנטי של צמחים ובעלי חיים, וייתכן שהיה חשוב בהתפתחות הגנום.[22] לדוגמא, יותר ממיליון עותקים מה- רצף אלו נוכחים ב גנום אנושי, ורצפים אלה גויסו כעת לביצוע פונקציות כגון ויסות ביטוי גנים.[23] השפעה נוספת של רצפי DNA ניידים אלה היא שכאשר הם נעים בתוך הגנום, הם יכולים לשנות או למחוק גנים קיימים ובכך לייצר מגוון גנטי.[6]
מוטציות לא קטלניות מצטברות בתוך מאגר גנים ולהגדיל את כמות השונות הגנטית.[24] ניתן להפחית את השפע של כמה שינויים גנטיים בתוך מאגר הגנים ברירה טבעית בעוד שמוטציות "טובות יותר" אחרות עשויות להצטבר ולהביא לשינויים הסתגלותיים.

לדוגמא, א פַּרְפַּר עשוי לייצר צֶאֱצָאִים עם מוטציות חדשות. לרוב המוטציות הללו לא תהיה כל השפעה; אבל אפשר לשנות את צֶבַע של אחד מצאצאי הפרפר, מה שמקשה (או קל יותר) לראות טורפים. אם שינוי צבע זה הוא יתרון, הסיכוי של פרפר זה לשרוד ולייצר צאצאים משלו מעט טוב יותר, ועם הזמן מספר הפרפרים עם המוטציה הזו עשוי להוות אחוז גדול יותר מהאוכלוסייה.
מוטציות נייטרליות מוגדרים כמוטציות שהשפעותיהן אינן משפיעות על כושר של יחיד. אלה יכולים לעלות בתדירות לאורך זמן בגלל סחף גנטי. הוא האמין כי לרוב המכריע של המוטציות אין השפעה משמעותית על כושרו של האורגניזם.[25][26] כמו כן, מנגנוני תיקון דנ"א מסוגלים לתקן את רוב השינויים לפני שהם הופכים למוטציות קבועות, ואורגניזמים רבים מכילים מנגנונים לביטול מוטציה אחרת-קבועה אחרת. תאים סומטיים.
מוטציות מועילות יכולות לשפר את הצלחת הרבייה.[27][28]
סיבות
ארבע סוגים של מוטציות הן (1) מוטציות ספונטניות (ריקבון מולקולרי), (2) מוטציות עקב עקיפת שכפול נוטה לטעויות של באופן טבעי נזק ל- DNA (נקרא גם סינתזת טרנסלציה מועדת לטעויות), (3) שגיאות שהוכנסו במהלך תיקון DNA ו- (4) מוטציות הנגרמות על ידי מוטגנים. מדענים עשויים גם להציג במכוון מוטציה רצפים באמצעות מניפולציה ב- DNA לצורך ניסויים מדעיים.
מחקר אחד משנת 2017 טען כי 66% מהמוטציות הגורמות לסרטן הן אקראיות, 29% נובעות מהסביבה (האוכלוסייה שנחקרה התפרשה על פני 69 מדינות), ו -5% עוברות בירושה.[29]
בני אדם מעבירים בממוצע 60 מוטציות חדשות לילדיהם אך אבות מעבירים יותר מוטציות בהתאם לגילם כאשר בכל שנה מוסיפים לילד שתי מוטציות חדשות.[30]
מוטציה ספונטנית
מוטציות ספונטניות להתרחש בסבירות שאינה אפסית אפילו נתון לתא בריא ולא מזוהם. על פי הערכות, נזק DNA חמצוני באופן טבעי מתרחש 10,000 פעמים לכל תא ביום בבני אדם ו 100,000 פעמים לכל תא ביום חולדות.[31] מוטציות ספונטניות יכולות להיות מאופיינות בשינוי הספציפי:[32]
- טאוטומריות - בסיס שונה על ידי מיקום מחדש של a מֵימָן אטום, ושינוי דפוס קשרי המימן של אותו בסיס וכתוצאה מכך שגוי זיווג בסיס במהלך שכפול.
- התנקשות אובדן א פורין בסיס (A או G) ליצירת אתר אפרורי (אתר AP ).
- דימנציה – הִידרוֹלִיזָה משנה בסיס רגיל לבסיס לא טיפוסי המכיל a קטו קבוצה במקום המקור אמין קְבוּצָה. דוגמאות כוללות C → U ו- A → HX (היפוקסנטין ), שניתן לתקן על ידי מנגנוני תיקון DNA; ו- 5MeC (5-מתיל ציטוזין ) → T, שככל הנראה פחות יתגלה כמוטציה תימין הוא בסיס DNA רגיל.
- התאמה שגויה של החלקה - דנטורציה של הגדיל החדש מהתבנית במהלך השכפול, ואחריו שינוי טבעי במקום אחר ("החלקה"). זה יכול להוביל להכנסות או למחיקות.
- החלקת שכפול
עוקף שכפול מועד לשגיאה
ישנן עדויות הולכות וגוברות לכך שרוב המוטציות המתעוררות באופן ספונטני נובעות משכפול נוטה לשגיאות (סינתזת מעבר ) נזק ל- DNA בעבר בגדיל התבנית. ב עכברים, רוב המוטציות נגרמות על ידי סינתזת מעבר.[33] כמו כן, ב שמרים Kunz et al.[34] מצא כי יותר מ- 60% מההחלפות והמחיקות הזוגיות הבסיסית הספונטנית נגרמו מסינתזת מעבר.
שגיאות שהוכנסו במהלך תיקון ה- DNA
למרות שהפסקות טבעיות כפולות מתרחשות באופן טבעי בתדירות נמוכה יחסית ב- DNA, התיקון שלהן גורם לעיתים קרובות למוטציה. הצטרפות סוף לא הומולוגית (NHEJ) הוא מסלול מרכזי לתיקון הפסקות גדולות כפולות. NHEJ כולל הסרה של כמה נוקלאוטידים כדי לאפשר יישור מעט לא מדויק של שני הקצוות להצטרפות מחדש ואחריו תוספת של נוקליאוטידים כדי להשלים פערים. כתוצאה מכך, NHEJ מציג לעתים קרובות מוטציות.[35]
מוטציה מושרה
מוטציות המושרות הן שינויים בגן לאחר שבא במגע עם מוטגנים וגורמים סביבתיים.
מוטציות הנגרמות ברמה המולקולרית יכולה להיגרם על ידי:
- כימיקלים
- הידרוקסילאמין
- אנלוגים בסיסיים (לְמָשָׁל., ברומודאוקסיורידין (BrdU))
- סוכני אלקילציה (לְמָשָׁל., נ-אֶתִיל-נ-ניטרוזוראה (ENU). סוכנים אלה יכולים למוטט DNA משכפל וגם לא משכפל. לעומת זאת, אנלוג בסיס יכול לשנות את ה- DNA רק כאשר האנלוג משולב בשכפול ה- DNA. לכל אחת מהסוגים האלה של מוטגנים כימיים יש השפעות מסוימות שמובילות לאחר מכן מעברים, התמרות, או מחיקות.
- סוכנים שנוצרים תוספי DNA (לְמָשָׁל., אוצרטוקסין א )[37]
- DNA משתלבים סוכנים (למשל, אתידיום ברומיד )
- צולבי DNA
- נזק חמצוני
- חומצה חנקתית ממיר קבוצות אמין ב- A ו- C ל- דיאזו קבוצות, תוך שינוי דפוסי קשירת המימן שלהם, מה שמוביל לזיווג בסיס שגוי במהלך השכפול.
- קְרִינָה
- אוּלְטרָה סָגוֹל אור (UV) (קרינה לא מייננת ). שני בסיסי נוקלאוטיד ב- DNA -ציטוזין ותימין - הם הפגיעים ביותר לקרינה שיכולה לשנות את תכונותיהם. אור UV יכול לגרום לצמוד פירימידין בסיסים בגדיל DNA כדי להתחבר קוולנטית כ- דימר פירימידין. קרינת UV, ובמיוחד UVA ארוך יותר, עלולה לגרום נזק חמצוני ל- DNA.[38]
- קרינה מייננת. חשיפה לקרינה מייננת, כגון קרינת גמא, יכול לגרום למוטציה, ואולי לגרום לסרטן או למוות.
בעוד שבעבר בעבר הונחה כי מוטציות מתרחשות במקרה או נגרמות על ידי מוטגנים, מנגנוני מוטציה מולקולריים התגלו בחיידקים וברחבי עץ החיים. כפי שאומר ס 'רוזנברג, "מנגנונים אלה חושפים תמונה של מוטגנזה מוסדרת מאוד, המווסתת באופן זמני על ידי תגובות לחץ ומופעלות כאשר התאים / אורגניזמים אינם מותאמים לסביבתם - כאשר הם לחוצים - ועלולים להאיץ את ההסתגלות."[39] מכיוון שהם מנגנונים מוטגניים המושרה על ידי עצמם המגבירים את קצב ההסתגלות של אורגניזמים, הם נקראו כמה פעמים כמנגנוני מוטגנזה מסתגלים, וכוללים את תגובת ה- SOS בחיידקים,[40] רקומבינציה חוץ רחמית חוץ רחמית[41] ואירועים כרומוזומליים אחרים כגון כפילויות.[39]
סיווג סוגים
לפי השפעה על המבנה
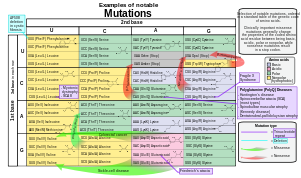
ניתן לשנות את רצף הגן במספר דרכים.[43] למוטציות גנטיות השפעות שונות על הבריאות, תלוי היכן הן מתרחשות והאם הן משנות את תפקודם של חלבונים חיוניים. ניתן לסווג מוטציות במבנה הגנים למספר סוגים.
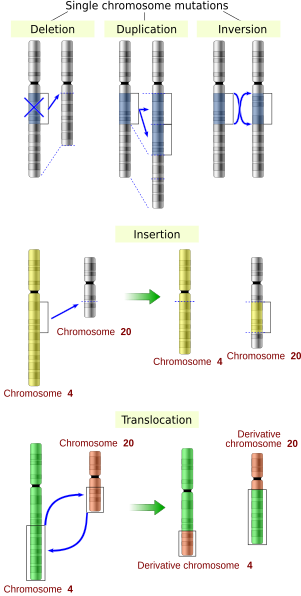
מוטציות בקנה מידה גדול
מוטציות בקנה מידה גדול ב כרומוזומלי המבנה כולל:
- הגברה (או כפילויות גנים ) או חזרה על קטע כרומוזומלי או נוכחות של חלק נוסף של כרומוזום שבור של כרומוזום עשוי להיקשר לכרומוזום הומולוגי או לא הומולוג, כך שחלק מהגנים קיימים ביותר משתי מנות שמובילות למספר עותקים של כל אזורים כרומוזומליים, הגדלת מינון הגנים הנמצאים בתוכם.
- מחיקות של אזורים כרומוזומליים גדולים, מה שמוביל לאובדן הגנים באזורים אלה.
- מוטציות שההשפעה שלהן היא להציב פיסות DNA נפרדות שקודם לכן, ובכך להביא יחדיו גנים נפרדים ליצירה מובחנת מבחינה תפקודית גנים היתוך (לְמָשָׁל., bcr-abl ).
- שינויים בקנה מידה גדול במבנה של כרומוזומים שקוראים לו סידור כרומוזומלי מחדש שיכול להוביל לירידה בכושר אבל גם ל speciation באוכלוסיות מבודדות, גזעיות. אלו כוללים:
- טרנסלוקציות כרומוזומליות: החלפת חלקים גנטיים מכרומוזומים לא-הומולוגיים.
- היפוך כרומוזומלי: היפוך הכיוון של קטע כרומוזומלי.
- לא הומולוגי מוצלב כרומוזומלי.
- מחיקות אינטרסטיציאליות: מחיקה תוך כרומוזומלית שמסירה קטע של DNA מכרומוזום יחיד, ובכך מיישמת גנים שהיו רחוקים בעבר. לדוגמא, תאים מבודדים מאדם אסטרוציטומה, סוג של גידול במוח, נמצא שיש מחיקה כרומוזומלית שמסירה רצפים בין ה Fused in Glioblastoma (FIG) לבין הקולטן טירוזין קינאז (ROS), ומייצר חלבון היתוך (FIG-ROS). לחלבון היתוך FIG-ROS הלא תקין יש פעילות קינאז אקטיבית שגורמת אונקוגני טרנספורמציה (טרנספורמציה מתאים נורמליים לתאים סרטניים).
- אובדן הטרוזיגוזיות: אובדן אחד אלל, באמצעות מחיקה או אירוע של רקומבינציה גנטית, באורגניזם שהיה לו בעבר שני אללים שונים.
מוטציות בקנה מידה קטן
מוטציות בקנה מידה קטן משפיעות על גן באחד או כמה נוקלאוטידים. (אם רק נוקלאוטיד יחיד מושפע, הם נקראים מוטציות נקודתיות.) מוטציות בקנה מידה קטן כוללות:
- הכנסות הוסף אחד או יותר נוקלאוטידים נוספים ל- DNA. הם נגרמים בדרך כלל על ידי אלמנטים ניתנים לשינוי, או שגיאות במהלך שכפול של אלמנטים חוזרים. הכנסות באזור הקידוד של גן עשויות להשתנות שחבור של ה mRNA (מוטציה של אתר אחוי ), או לגרום לשינוי ב- מסגרת קריאה (העברת מסגרות שניהם יכולים לשנות באופן משמעותי את מוצר גנים. ניתן להפוך את ההכנסות על ידי כריתה של האלמנט הניתן להעברה.
- מחיקות להסיר אחד או יותר נוקליאוטידים מה- DNA. כמו הכנסות, מוטציות אלה יכולות לשנות את מסגרת הקריאה של הגן. באופן כללי, הם בלתי הפיכים: למרות שאותו רצף בדיוק ניתן, באופן תיאורטי, לשחזר באמצעות הכנסת אלמנטים הניתנים לשינוי שיכולים להחליף מחיקה קצרה מאוד (נניח 1-2 בסיסים) כל מאוד לא סביר שקיימים מיקום או שהם בכלל לא קיימים.
- מוטציות החלפה, הנגרמת לעיתים קרובות מכימיקלים או תקלה בשכפול דנ"א, מחליפים נוקלאוטיד יחיד לאחר.[44] שינויים אלה מסווגים כמעברים או מעברים.[45] הנפוץ ביותר הוא המעבר המחליף פורין לפורין (A ↔ G) או a פירימידין עבור פירימידין, (C ↔ T). מעבר יכול להיגרם על ידי חומצה חנקתית, התאמה לא נכונה של בסיס או אנלוגים בסיסיים מוטגניים כגון BrdU. פחות נפוץ הוא טרנסברסיה, שמחליפה פורין בפירימידין או פירימידין בפורין (C / T ↔ A / G). דוגמה להמרה היא המרה של אדנין (א) לציטוזין (ג). מוטציות נקודתיות הן שינויים של זוגות בסיס בודדים של DNA או זוגות בסיס קטנים אחרים בתוך גן. ניתן להפוך מוטציה נקודתית על ידי מוטציה נקודתית אחרת, שבה נוקלאוטיד מוחלף חזרה למצבו המקורי (היפוך אמיתי) או על ידי היפוך מהמקום השני (מוטציה משלימה במקום אחר שמביא להחזרת פונקציונליות גנטית). כפי שנדון לְהַלָן, מוטציות נקודתיות המתרחשות בתוך החלבון אזור קידוד של גן ניתן לסווג כ- נִרדָף אוֹ החלפות לא נרדפות, האחרון שבהם ניתן לחלק missense אוֹ מוטציות שטויות.
על ידי השפעה על רצף החלבונים

ההשפעה של מוטציה על רצף החלבונים תלויה בחלקה היכן בגנום היא מתרחשת, במיוחד אם היא נמצאת ב- a סִמוּל אוֹ אזור שאינו קידוד. מוטציות באי-קידוד רצפים רגולטוריים של גן, כגון מקדמים, משפרי ומשתיקי קול, יכולים לשנות את רמות הביטוי הגנטי, אך הם נוטים פחות לשנות את רצף החלבון. מוטציות בפנים אינטרונים ובאזורים ללא פונקציה ביולוגית ידועה (למשל פסאודוגנים, רטרו-טרנספוזונים ) הם בדרך כלל ניטראלי, ללא השפעה על פנוטיפ - אם כי מוטציות אינטרון יכולות לשנות את מוצר החלבון אם הן משפיעות על שחבור ה- mRNA.
מוטציות המתרחשות באזורים מקודדים של הגנום נוטות יותר לשנות את מוצר החלבון, וניתן לסווג אותן לפי השפעתן על רצף חומצות האמינו:
- א מוטציה למסגר נגרמת על ידי החדרה או מחיקה של מספר נוקלאוטידים שאינם מתחלקים באופן שווה לשלושה מתוך רצף DNA. בשל האופי המשולש של ביטוי גנים על ידי קודונים, הכניסה או המחיקה עלולים לשבש את מסגרת הקריאה, או את קיבוץ הקודונים, וכתוצאה מכך שונה לחלוטין תִרגוּם מהמקור.[46] ככל שהמחיקה או ההחדרה מתרחשת מוקדם יותר ברצף, כך החלבון המיוצר שונה יותר. (לדוגמה, הקוד CCU GAC UAC CUA מקודד לחומצות האמינו פרולין, חומצה אספרטית, טירוזין ולאוצין. אם ה- U ב- CCU יימחק, הרצף שהתקבל יהיה CCG ACU ACC UAx, שבמקום זה יקודד לפרולין, תראונין, תריאונין וחלק מחומצת אמינו אחרת או אולי א עצור קודון (כאשר ה- x מייצג את הנוקליאוטיד הבא).) לעומת זאת, כל הכנסה או מחיקה המתחלקים באופן שווה בשלושה נקראים " מוטציה בתוך המסגרת.
- מוטציה של החלפת נקודה מביאה לשינוי בגרעין יחיד ויכולה להיות שם נרדף או לא שם נרדף.
- א החלפה נרדפת מחליף קודון בקודון אחר שמקודד לאותה חומצת אמינו, כך שרצף חומצות האמינו המיוצר לא ישתנה. מוטציות נרדפות מתרחשות עקב דֵגֵנֵרָט הטבע של קוד גנטי. אם מוטציה זו אינה גורמת להשפעות פנוטיפיות כלשהן, הרי שהיא נקראת שקט, אך לא כל החלפות נרדפות שותקות. (יכולות להיות גם מוטציות שקטות בנוקליאוטידים מחוץ לאזורי הקידוד, כגון האינטרונים, מכיוון שרצף הנוקליאוטידים המדויק אינו קריטי כמו באזורי הקידוד, אך אלה אינם נחשבים להחלפות נרדפות.)
- א החלפה לא נרדפת מחליף קודון בקודון אחר שמקודד לחומצת אמינו אחרת, כך שרצף חומצות האמינו המיוצר משתנה. ניתן לסווג החלפות לא-נרדפות כשטויות או מוטציות של מיסנס:
- א מוטציה של מיסנס משנה נוקלאוטיד כדי לגרום להחלפת חומצת אמינו אחרת. זה בתורו יכול להפוך את החלבון המתקבל ללא פונקציונלי. מוטציות כאלה אחראיות למחלות כמו אפידרמוליזה בולוסה, מחלת מגל, ו SOD1 אמצעי ALS.[47] מצד שני, אם מוטציה של מיסנס מתרחשת בקודון חומצת אמינו המביאה לשימוש בחומצת אמינו שונה אך דומה מבחינה כימית, אז לעיתים מעט או ללא שינוי בחלבון. לדוגמא, שינוי מ- AAA ל- AGA יקודד ארגינין, מולקולה הדומה כימית למיועדת ליזין. במקרה האחרון זה למוטציה תהיה השפעה מועטה או לא על פנוטיפ ולכן תהיה ניטראלי.
- א מוטציה של שטויות היא מוטציה נקודתית ברצף של DNA המביא לקודון עצירה מוקדם, או a קודון שטויות ב- mRNA המועתק, ואולי מוצר חלבון קטום ולעתים קרובות לא מתפקד. סוג זה של מוטציה נקשר למחלות שונות, כגון היפרפלזיה מולדת של הכליה. (לִרְאוֹת עצור קודון.)
לפי השפעה על פונקציה
- מוטציות של אובדן תפקוד, הנקראות גם מוטציות שאינן מפעילות, גורמות לכך שלמוצר הגן יש פחות או ללא תפקוד (בהיותו מנוטרל באופן חלקי או לחלוטין). כאשר לאלל אובדן תפקוד מוחלט (אלל אפס ), זה נקרא לעתים קרובות אמורף או מוטציה אמורפית ב מורפריו של מולר סכֵימָה. פנוטיפים הקשורים למוטציות כאלה הם לרוב רצסיבי. יוצאים מן הכלל הם כאשר האורגניזם הוא הפלואידי, או כאשר המינון המופחת של מוצר גנים תקין אינו מספיק לפנוטיפ תקין (זה נקרא מחסור בתקלות ).
- מוטציות של רווח-תפקוד, הנקראות גם מוטציות הפעלה, משנות את תוצר הגן כך שהשפעתו מתחזקת (הפעלה משופרת) או אפילו מוחלפת על ידי פונקציה שונה וחריגה. כאשר נוצר האלל החדש, א הטרוזיגוטה המכיל את האלל החדש שנוצר כמו גם את המקור יביע את האלל החדש; מבחינה גנטית זה מגדיר את המוטציות כ- דוֹמִינָנטִי פנוטיפים. כמה מהמורפים של מולר תואמים את רווח התפקוד, כולל היפרמורף (ביטוי גנים מוגבר) ונוירוף (פונקציה חדשה). בדצמבר 2017 ביטלה ממשלת ארה"ב איסור זמני שיושם בשנת 2014, שאסר על מימון פדרלי לכל ניסוי "רווח-פונקציה" חדש שמשפר את הפתוגנים "כמו שפעת העופות, סארס ונגיפי הנשימה במזרח התיכון או נגיפי MERS."[48][49]
- מוטציות שליליות דומיננטיות (נקראות גם אנטימורפי מוטציות) יש תוצר גנטי שונה הפועל בצורה אנטגוניסטית לאלל מסוג הבר. מוטציות אלו גורמות בדרך כלל לתפקוד מולקולרי שונה (לעיתים בלתי פעיל) והן מאופיינות בדומיננטית או חצי דומיננטי פנוטיפ. בבני אדם מוטציות שליליות דומיננטיות היו מעורבות בסרטן (למשל, מוטציות בגנים p53,[50] כַּספּוֹמָט,[51] CEBPA[52] ו PPARgamma[53]). תסמונת מרפן נגרמת על ידי מוטציות ב FBN1 גן, ממוקם על כרומוזום 15, המקודד פיברילין -1, א גליקופרוטאין רכיב של מטריצה חוץ תאית.[54] תסמונת מרפן היא גם דוגמה למוטציה שלילית דומיננטית וללא ספיקה.[55][56]
- היפומורפים, לאחר סיווג מולריאן, מאופיינים במוצרי גנים משתנים הפועלים עם ירידה ביטוי גנים בהשוואה ל טיפוס פראי אלל. בדרך כלל, מוטציות היפומורפיות הן רצסיביות, אך אי ספיקת הפלואינס גורמת לאללים מסוימים להיות דומיננטיים.
- Neomorphs מאופיינים בשליטה של חדש חֶלְבּוֹן סינתזת מוצרים.
- מוטציות קטלניות הן מוטציות המובילות למותם של האורגניזמים הנושאים את המוטציות.
- מוטציה או היפוך גב הם מוטציה נקודתית המשקמת את הרצף המקורי ומכאן הפנוטיפ המקורי.[57]
לפי השפעה על הכושר
בשימוש גנטיקה, נהוג לדבר על מוטציות כמזיקות או כמועילות.
- מוטציה מזיקה, או מזיקה, מקטינה את כושרו של האורגניזם.
- מוטציה מועילה או מועילה מגבירה את כושר האורגניזם.
- למוטציה ניטרלית אין השפעה מזיקה או מועילה על האורגניזם. מוטציות כאלה מתרחשות בקצב קבוע, ויוצרות את הבסיס ל- שעון מולקולרי. בתוך ה תיאוריה נייטרלית של התפתחות מולקולרית, מוטציות ניטרליות מספקות סחיפה גנטית כבסיס לרב השונות ברמה המולקולרית.
- מוטציה כמעט נייטרלית היא מוטציה שעשויה להיות מעט מזיקה או מועילה, אם כי רוב המוטציות כמעט ניטרליות מעט מזיקות.
הפצת אפקטים של כושר
נעשו ניסיונות להסיק את חלוקת אפקטים של כושר (DFE) באמצעות מוטגנזה ניסויים ומודלים תיאורטיים המיושמים על נתוני רצף מולקולרי. DFE, כפי שהוא משמש לקביעת השפע היחסי של סוגים שונים של מוטציות (כלומר, מזיק מאוד, כמעט ניטרלי או יתרון), רלוונטי לשאלות אבולוציוניות רבות, כגון שמירה על וריאציה גנטית,[58] המדרג של ריקבון גנומי,[59] התחזוקה של חוצה רבייה מינית בניגוד ל הרבייה[60] ואת האבולוציה של מִין ו רקומבינציה גנטית.[61] ניתן לעקוב אחר DFE גם על ידי מעקב אחר הטיה של התפלגות המוטציות עם השפעות קשות לכאורה בהשוואה להתפלגות המוטציות עם השפעה קלה או נעדרת כביכול.[62] לסיכום, ל- DFE תפקיד חשוב בחיזוי דינמיקה אבולוציונית.[63][64] מגוון גישות שימשו לחקר ה- DFE, כולל שיטות תיאורטיות, ניסיוניות ואנליטיות.
- ניסוי מוטגנזה: השיטה הישירה לחקור את ה- DFE היא לגרום למוטציות ואז למדוד את השפעות הכושר המוטציה, שכבר בוצעו בנגיפים. בַּקטֶרִיָה, שמרים, ו דרוזופילה. לדוגמא, רוב המחקרים על DFE בנגיפים המשמשים מוטגנזה מכוונת אתרים ליצור מוטציות נקודתיות ולמדוד כושר יחסי של כל מוטציה.[65][66][67][68] ב אי קולי, נעשה שימוש במחקר אחד טרנספוזון מוטגנזה כדי למדוד ישירות את הכושר של הכנסה אקראית של נגזרת של Tn10.[69] בשמרים, מוטגנזה משולבת ו רצף עמוק הגישה פותחה כדי ליצור ספריות מוטציות שיטתיות באיכות גבוהה ולמדוד כושר בתפוקה גבוהה.[70] עם זאת, בהתחשב בכך שלמוטציות רבות יש השפעות קטנות מכדי שניתן יהיה לאתר אותן[71] וכי ניסויים במוטגנזה יכולים לזהות רק מוטציות בעלות השפעה גדולה למדי; DNA ניתוח נתוני רצף יכול לספק מידע רב ערך על מוטציות אלה.
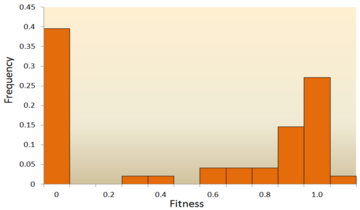
- ניתוח רצף מולקולרי: עם התפתחות מהירה של רצף DNA טכנולוגיה, כמות עצומה של נתוני רצף דנ"א זמינה ועוד יותר צפויה בעתיד. פותחו שיטות שונות להסיק את ה- DFE מנתוני רצף ה- DNA.[72][73][74][75] על ידי בחינת הבדלי רצף DNA בין מינים ובין אלה, אנו מסוגלים להסיק מאפיינים שונים של ה- DFE למוטציות ניטרליות, מזיקות ויתרונות.[24] ליתר דיוק, הגישה לניתוח רצף ה- DNA מאפשרת לנו לאמוד את ההשפעות של מוטציות בעלות השפעות קטנות מאוד, שכמעט ולא ניתן לזהות אותן באמצעות ניסויים של מוטגנזה.
אחד המחקרים העיוניים המוקדמים ביותר על התפלגות השפעות הכושר נעשה על ידי מוטו קימורה, אוכלוסייה תיאורטית משפיעה גנטיקאי. התיאוריה הנייטרלית שלו לגבי האבולוציה המולקולרית מציעה שרוב המוטציות החדשות יהיו מזיקות מאוד, כאשר חלק קטן יהיה ניטרלי.[76][25] הירושי אקשי הציע לאחרונה א בימודל מודל ל- DFE, עם מצבים שבמרכזם מוטציות מזיקות ונייטרליות ביותר.[77] שתי התיאוריות מסכימות כי הרוב המכריע של המוטציות החדשות הן ניטרליות או מזיקות וכי מוטציות מועילות הן נדירות, אשר נתמכו על ידי תוצאות ניסוי. דוגמה אחת היא מחקר שנערך על DFE של מוטציות אקראיות ב- נגיף סטומטיטיס שלפוחית.[65] מתוך כל המוטציות, 39.6% היו קטלניים, 31.2% היו לא קטלניים ו -27.1% היו ניטרליים. דוגמה נוספת מגיעה מניסוי מוטגנזה בתפוקה גבוהה עם שמרים.[70] בניסוי זה הוצג כי ה- DFE הכולל הוא דו-מודאלי, עם מקבץ של מוטציות ניטרליות, והפצה רחבה של מוטציות מזיקות.
למרות שמעט מאוד מוטציות מועילות, אלו שמשחקות תפקיד חשוב בשינויים אבולוציוניים.[78] כמו מוטציות נייטרליות, מוטציות יתרון שנבחרו חלש יכולות לאבד בגלל סחף גנטי אקראי, אך סביר יותר שתתקבע מוטציות יתרון שנבחרו חזק. הכרת ה- DFE של מוטציות מועילות עשויה להוביל ליכולת מוגברת לחזות את הדינמיקה האבולוציונית. העבודה התיאורטית על ה- DFE למוטציות מועילות נעשתה על ידי ג'ון ה 'גילספי[79] ו ה 'אלן אור.[80] הם הציעו כי ההפצה למוטציות מועילות צריכה להיות אקספוננציאלי במגוון רחב של תנאים, אשר, באופן כללי, נתמכו על ידי מחקרים ניסיוניים, לפחות עבור מוטציות מועילות שנבחרו מאוד.[81][82][83]
באופן כללי מקובל שרוב המוטציות הן ניטרליות או מזיקות, כאשר מוטציות מועילות הן נדירות; עם זאת, שיעור סוגי המוטציות משתנה בין המינים. זה מצביע על שתי נקודות חשובות: ראשית, שיעור המוטציות הנטרליות האפקטיביות עשוי להשתנות בין המינים, כתוצאה מהתלות ב גודל אוכלוסייה יעיל; שנית, ההשפעה הממוצעת של מוטציות מזיקות משתנה באופן דרמטי בין המינים.[24] בנוסף, ה- DFE שונה גם בין אזורי קידוד לבין אזורים שאינם מקודדים, עם ה- DFE של ה- DNA שאינו מקודד המכיל מוטציות שנבחרו בצורה חלשה יותר.[24]
על ידי ירושה
ב אורגניזמים רב תאיים עם ייעודי תאי רבייה, ניתן לחלק את המוטציות ל מוטציות בקו הנבט, שניתן להעביר לצאצאים דרך תאי הרבייה שלהם, ו סומטי מוטציות (נקראות גם מוטציות נרכשות),[84] אשר מערבים תאים מחוץ לקבוצת הרבייה הייעודית ואשר בדרך כלל אינם מועברים לצאצאים.
אורגניזמים דיפלואידים (למשל, בני אדם) מכילים שני עותקים של כל גן - אלל אבהי ואלם אימהי. בהתבסס על המופע של מוטציה בכל כרומוזום, אנו עשויים לסווג מוטציות לשלושה סוגים. א טיפוס פראי או אורגניזם הומוזיגוזי שאינו מוטציה הוא אחד בו אף אלל אינו מוטציה.
- מוטציה הטרוזיגית היא מוטציה של אלל אחד בלבד.
- מוטציה הומוזיגוטית היא מוטציה זהה של האללים האבהיים והאלים.
- מתחם הטרוזיגוט מוטציות או תרכובת גנטית מורכבת משתי מוטציות שונות באללים האבהיים והאם.[85]
מוטציה של הנבט
מוטציה בקו הנבט בתאי הרבייה של אדם מוליד a מוטציה חוקתית אצל הצאצאים, כלומר מוטציה שקיימת בכל תא. מוטציה חוקתית יכולה להתרחש גם זמן קצר לאחר מכן הַפרָיָה, או להמשיך ממוטציה חוקתית קודמת אצל הורה.[86] ניתן להעביר מוטציה של חיידקים דרך הדורות הבאים של אורגניזמים.
ההבחנה בין מוטציה לקוטית לבין מוטציות סומטיות חשובה אצל בעלי חיים שיש להם קו נבט ייעודי לייצור תאי רבייה. עם זאת, אין ערך רב בהבנת ההשפעות של מוטציות בצמחים, אשר חסרות קו נבט ייעודי. ההבחנה מטושטשת גם באותם בעלי חיים ש להתרבות מינית באמצעות מנגנונים כגון נִבגִי מכיוון שהתאים שמולידים את אורגניזמי הבת מולידים גם את קו הנבט של אותו אורגניזם.
מוטציה חדשה של קו הנבט שלא עוברת בירושה משני ההורים נקראת a דה נובו מוּטָצִיָה.
מוטציה סומטית
שינוי במבנה הגנטי שלא עובר בירושה מהורה, וגם לא מועבר לצאצאים, נקרא a סומטי מוּטָצִיָה.[84] מוטציות סומטיות אינן עוברות בירושה על ידי צאצאיו של האורגניזם מכיוון שאינן משפיעות על קו נבט. עם זאת, הם מועברים לכל הצאצאים של תא מוטציה בתוך אותו אורגניזם במהלך המיטוזה. לכן חלק מרכזי באורגניזם עשוי לשאת את אותה המוטציה. מוטציות מסוג זה נגרמות בדרך כלל מסיבות סביבתיות, כגון קרינה אולטרה סגולה או כל חשיפה לכימיקלים מזיקים מסוימים, ועלולות לגרום למחלות כולל סרטן.[87]
עם צמחים ניתן להפיץ כמה מוטציות סומטיות ללא צורך בייצור זרעים, למשל השתלה וגזרי גזע. סוג זה של מוטציות הוביל לסוגים חדשים של פירות, כגון "טעים" תפוח עץ וטבור "וושינגטון" תפוז.[88]
אנושי ועכבר תאים סומטיים בעלי שיעור מוטציות הגבוה פי עשרה מה- קו נבט שיעור המוטציות לשני המינים; לעכברים יש שיעור גבוה יותר של מוטציות סומטיות והן של מוטציות בקו חלוקת תא מאשר בני אדם. הפער בשיעור המוטציה בין קו הנבט לרקמות הסומטיות משקף ככל הנראה את החשיבות הגדולה יותר של גנום תחזוקה בקו הנבט מאשר בסומה.[89]
שיעורים מיוחדים
- מוטציה מותנית היא מוטציה שיש לה פנוטיפ פראי-טיפוסי (או פחות חמור) בתנאים סביבתיים "מתירניים" מסוימים ופנוטיפ מוטנטי בתנאים "מגבילים" מסוימים. לדוגמא, מוטציה רגישה לטמפרטורה עלולה לגרום למוות של תאים בטמפרטורה גבוהה (מצב מגביל), אך עשויה שלא להיות לה השלכות מזיקות בטמפרטורה נמוכה יותר (מצב מתיר).[90] מוטציות אלה אינן אוטונומיות, שכן הביטוי שלהן תלוי בנוכחות תנאים מסוימים, בניגוד למוטציות אחרות המופיעות באופן אוטונומי.[91] התנאים המתירניים עשויים להיות טֶמפֶּרָטוּרָה,[92] כימיקלים מסוימים,[93] אוֹר[93] או מוטציות בחלקים אחרים של גנום.[91] ב ויוו מנגנונים כמו מתגי תעתיק יכולים ליצור מוטציות מותנות. לדוגמה, שיוך של תחום קשירת סטרואידים יכול ליצור מתג תעתיק שיכול לשנות את הביטוי של גן על בסיס נוכחות של ליגנד סטרואידים.[94] למוטציות מותנות יש יישומים במחקר מכיוון שהם מאפשרים שליטה בביטוי גנים. זה שימושי במיוחד בלימוד מחלות אצל מבוגרים בכך שהוא מאפשר ביטוי לאחר תקופת צמיחה מסוימת, ובכך מבטל את ההשפעה המזיקה של ביטוי גנים שנראה בשלבי התפתחות באורגניזמים מודליים.[93] מערכות DNA רקומבינאז כמו שילוב מחדש של Cre-Lox משמש בשיתוף עם מקדמים המופעלים בתנאים מסוימים יכולים ליצור מוטציות מותנות. ניתן להשתמש בטכנולוגיית רקומבינאז כפולה כדי לגרום למוטציות מותנות מרובות לחקר המחלות המתבטאות כתוצאה ממוטציות בו זמנית בגנים מרובים.[93] מסוים אינטיינים זוהו המתפצלים רק בטמפרטורות מותרות מסוימות, מה שמוביל לסינתזת חלבונים לא נכונה ובכך, מוטציות של אובדן תפקוד בטמפרטורות אחרות.[95] ניתן להשתמש במוטציות מותנות גם במחקרים גנטיים הקשורים להזדקנות, מכיוון שניתן לשנות את הביטוי לאחר פרק זמן מסוים באורך החיים של האורגניזם.[92]
- תזמון שכפול תכונות כמותיות משפיע על שכפול DNA.
מִנוּחַ
על מנת לסווג מוטציה ככזו, יש להשיג את הרצף ה"נורמלי "מה- DNA של אורגניזם" רגיל "או" בריא "(בניגוד לזה" מוטציה "או" חולה "), יש לזהות אותו דיווחו; באופן אידיאלי, הוא אמור להיות זמין לציבור להשוואה נוקלאוטידית-אחר-נוקלאוטיד, ולהסכים עליה על ידי הקהילה המדעית או על ידי קבוצה של גנטיקאים מומחים ו ביולוגים, שבאחריותם להקים את תֶקֶן או מה שנקרא רצף "קונצנזוס". שלב זה דורש מאמץ מדעי אדיר. לאחר שידוע על רצף הקונצנזוס, ניתן לאתר, לתאר ולסווג את המוטציות בגנום. הוועדה של האגודה לשינוי הגנום האנושי (HGVS) פיתחה את המינוח הסטנדרטי של גרסאות אנושיות,[96] אשר אמור לשמש חוקרים ו אבחון DNA מרכזים ליצירת תיאורי מוטציות חד משמעיים. באופן עקרוני, ניתן להשתמש במינוח זה גם לתיאור מוטציות באורגניזמים אחרים. המינוח מציין את סוג המוטציה והשינויים בבסיס או בחומצת האמינו.
- החלפת נוקלאוטיד (למשל, 76A> T) - המספר הוא המיקום של הנוקלאוטיד מקצה 5 '; האות הראשונה מייצגת את הנוקלאוטיד הטבעי, והאות השנייה מייצגת את הנוקלאוטיד שהחליף את סוג הבר. בדוגמה הנתונה, האדנין במיקום 76 הוחלף בתימין.
- אם יש צורך להבדיל בין מוטציות ב DNA גנומי, DNA מיטוכונדריאלי, ו RNA, נעשה שימוש במוסכמה פשוטה. לדוגמא, אם הבסיס ה -100 של רצף נוקלאוטיד מוטציה מ- G ל- C, אז הוא ייכתב כ- g.100G> C אם המוטציה התרחשה ב- DNA גנומי, m.100G> C אם המוטציה התרחשה ב- DNA מיטוכונדריאלי, או r.100g> c אם המוטציה התרחשה ב- RNA. שים לב, עבור מוטציות ב- RNA, קוד הנוקליאוטידים כתוב באותיות קטנות.
- החלפת חומצת אמינו (למשל, D111E) - האות הראשונה היא האות האחת קוד של חומצת אמינו פראית, המספר הוא המיקום של חומצת האמינו מ- מסוף N, והאות השנייה היא קוד האות האחד של חומצת האמינו הקיימת במוטציה. מוטציות שטויות מיוצגות עם X עבור חומצת האמינו השנייה (למשל D111X).
- מחיקת חומצות אמינו (למשל, ΔF508) - האות היוונית Δ (דֶלתָא ) מציין מחיקה. המכתב מתייחס לחומצת האמינו הקיימת בסוג הבר והמספר הוא המיקום מסוף N של חומצת האמינו אם היה קיים כמו בסוג הבר.
שיעורי מוטציה
שיעורי מוטציה משתנים באופן משמעותי בין המינים, וכוחות האבולוציה הקובעים בדרך כלל את המוטציה הם נושא לחקירה מתמשכת.
ב בני אנוש, ה קצב מוטציה הוא בערך 50-90 דה נובו מוטציות לגנום לדור, כלומר כל אדם צובר כ- 50-90 מוטציות חדשות שלא היו קיימות אצל הוריו. מספר זה נקבע על ידי רצף אלפי שלישות אנושיות, כלומר שני הורים ולפחות ילד אחד.[97]
הגנום של נגיפי RNA מבוססים על RNA ולא DNA. הגנום הנגיפי של ה- RNA יכול להיות כפול גדילי (כמו ב- DNA) או חד גדילי. בחלק מהנגיפים הללו (כגון חד-גדילי וירוס כשל חיסוני אנושי ), שכפול מתרחש במהירות, ואין מנגנונים לבדיקת דיוק הגנום. תהליך נוטה לשגיאה זה גורם לעיתים קרובות למוטציות.
סיבתיות למחלות
שינויים ב- DNA הנגרמים על ידי מוטציה באזור קידוד של ה- DNA עלולים לגרום לשגיאות ברצף החלבונים העלולות לגרום לחלבונים שאינם תפקודיים באופן חלקי או לחלוטין. כל תא, על מנת לתפקד כראוי, תלוי באלפי חלבונים כדי לתפקד במקומות הנכונים בזמנים הנכונים. כאשר מוטציה משנה חלבון הממלא תפקיד קריטי בגוף, יכול להיווצר מצב רפואי. מחקר אחד על השוואת גנים בין מינים שונים של דרוזופילה מצביע על כך שאם מוטציה אכן משנה חלבון, ככל הנראה המוטציה תהיה מזיקה, כאשר על פי הערכות 70 אחוזים מפולימורפיזם של חומצות אמינו יש השפעות מזיקות, והיתר יהיה ניטרלי או מועיל חלש.[8] מוטציות מסוימות משנות את רצף בסיס ה- DNA של הגן אך אינן משנות את החלבון שיוצר הגן. מחקרים הראו שרק 7% ממוטציות הנקודה ב- DNA הלא מקודד של שמרים הן מזיקות ו -12% ב- DNA המקודד הן מזיקות. שאר המוטציות הן ניטרליות או מועילות מעט.[98]
הפרעות תורשתיות
אם קיימת מוטציה ב- תא חיידקי, זה יכול להוליד צאצאים הנושאים את המוטציה בכל תאיו. זה המקרה במחלות תורשתיות. בפרט, אם יש מוטציה בגן לתיקון DNA בתוך תא נבט, בני אדם הנושאים מוטציות כאלה של קו נבט עשויים להיות בסיכון מוגבר לסרטן. רשימה של 34 מוטציות כאלה של חיידקים ניתנת במאמר הפרעת מחסור בתיקון DNA. דוגמה לאחת היא לַבקָנוּת, מוטציה המתרחשת בגן OCA1 או OCA2. אנשים הסובלים מהפרעה זו נוטים יותר לסוגים רבים של סרטן, להפרעות אחרות וליקויי ראייה.
נזק לדנ"א עלול לגרום לשגיאה בעת שכפול הדנ"א, ושגיאת שכפול זו עלולה לגרום למוטציה גנטית שעלולה לגרום להפרעה גנטית. נזקי DNA מתקנים על ידי מערכת תיקון ה- DNA של התא. לכל תא מספר מסלולים שדרכם אנזימים מזהים ונזקים בנזקים בתיקון. מכיוון ש- DNA יכול להיפגע במובנים רבים, תהליך תיקון ה- DNA הוא דרך חשובה בה הגוף מגן על עצמו מפני מחלות. לאחר שנזק ל- DNA הביא למוטציה, לא ניתן לתקן את המוטציה.
תפקיד בסרטן
מצד שני, מוטציה עלולה להתרחש בתא סומטי של אורגניזם. מוטציות כאלה יהיו קיימות בכל צאצאי התא הזה בתוך אותו אורגניזם. הצטברות של מוטציות מסוימות לאורך דורות של תאים סומטיים היא חלק מהגורם ל טרנספורמציה ממאירה, מתא רגיל לתא סרטני.[99]
תאים עם מוטציות אובדן תפקוד הטרוזיגוטים (עותק טוב אחד של הגן ועותק אחד מוטציה) עשויים לתפקד כרגיל עם העותק הבלתי מוחלט עד שהעותק הטוב עבר מוטציה ספונטנית. מוטציה מסוג זה מתרחשת לעיתים קרובות באורגניזמים חיים, אך קשה למדוד את הקצב. מדידת קצב זה חשובה בחיזוי הקצב שבו אנשים עלולים לחלות בסרטן.[100]
מוטציות נקודתיות עשויות לנבוע ממוטציות ספונטניות המתרחשות במהלך שכפול DNA. קצב המוטציה עשוי להיות מוגבר על ידי מוטגנים. מוטגנים יכולים להיות פיזיים, כגון קרינה מ קרני UV, צילומי רנטגן או חום קיצוני, או כימי (מולקולות שממקמות זוגות בסיס או משבשות את צורת הסליל של ה- DNA). מוטגנים הקשורים לסרטן נלמדים לעיתים קרובות כדי ללמוד על סרטן ומניעתו.
מוטציות פריון
פריונים הם חלבונים ואינם מכילים חומר גנטי. עם זאת, הוכח כי שכפול פריונים כפוף למוטציות ולברירה טבעית בדיוק כמו צורות שכפול אחרות.[101] הגן האנושי PRNP קודים לחלבון הפריון העיקרי, PrP, והוא כפוף למוטציות העלולות לגרום לפריונים הגורמים למחלות.
מוטציות מועילות
למרות שמוטציות הגורמות לשינויים ברצפי החלבון עלולות להזיק לאורגניזם, לעיתים ההשפעה עשויה להיות חיובית בסביבה נתונה. במקרה זה, המוטציה עשויה לאפשר לאורגניזם המוטנטי לעמוד בלחצים סביבתיים מסוימים טוב יותר מאשר אורגניזמים פראיים, או להתרבות מהר יותר. במקרים אלה מוטציה נוטה להיות נפוצה יותר באוכלוסיה באמצעות הברירה הטבעית. דוגמאות כוללות:
עמידות ל- HIV: מחיקת זוג בסיסים ספציפית של 32 בבני אדם CCR5 (CCR5-Δ32 ) מעניק HIV התנגדות ל הומוזיגוטים ועיכובים איידס הופעה בהטרוזיגוטים.[102] הסבר אפשרי אחד ל אֶטִיוֹלוֹגִיָה בתדירות הגבוהה יחסית של CCR5-Δ32 ב אֵירוֹפִּי האוכלוסייה היא שהיא העניקה התנגדות ל מגפת דבר באמצע המאה ה -14 אֵירוֹפָּה. אנשים עם מוטציה זו היו בעלי סיכוי גבוה יותר לשרוד זיהום; וכך התדירות שלה באוכלוסייה גדלה.[103] תיאוריה זו יכולה להסביר מדוע לא ניתן למצוא מוטציה זו דרום אפריקה, שנשאר ללא נגיעה ממגפה בועית. תיאוריה חדשה יותר מציעה כי לחץ סלקטיבי על המוטציה CCR5 של דלתא 32 נגרמה על ידי אֲבַעבּוּעוֹת במקום המגיפה הבועית.[104]
התנגדות למלריה: דוגמה למוטציה מזיקה היא מחלת מגל, הפרעת דם בה הגוף מייצר סוג לא תקין של החומר הנושא חמצן הֵמוֹגלוֹבִּין בתוך ה תאי דם אדומים. שליש מכל יְלִידִי תושבי אפריקה שמדרום לסהרה לשאת את האלל, כי באזורים שבהם מָלַרִיָה נפוץ, יש א ערך הישרדותי בנשיאת אלל מגל יחיד בלבד (תכונה של מגל ).[105] אלה עם רק אחד משני האללים של מחלת המגל עמידים יותר למלריה, מאז התפשטות המלריה. פלסמודיום נעצר על ידי מגל התאים שהוא שורץ בו.
עמידות לאנטיביוטיקה: כמעט כל החיידקים מפתחים עמידות לאנטיביוטיקה כאשר הם נחשפים לאנטיביוטיקה. למעשה, לאוכלוסיות חיידקים כבר יש מוטציות כאלה שנבחרות תחת בחירה אנטיביוטית.[106] ברור שמוטציות כאלה מועילות רק לחיידקים אך לא לנדבקים.
התמדה של לקטאז. מוטציה אפשרה לבני אדם לבטא את האנזים לקטאז לאחר שהם נגמלים באופן טבעי מחלב אם, מה שמאפשר למבוגרים לעכל לקטוז, שהיא ככל הנראה אחת המוטציות המועילות ביותר לאחרונה אבולוציית האדם.[107]
הִיסטוֹרִיָה

מוטציה הוא אחד מכמה חלופות לאבולוציה על ידי הברירה הטבעית שהיו קיימים לפני ואחרי פרסום צ'ארלס דארווין ספרו משנת 1859, על מקור המינים. בתיאוריה, מוטציה הייתה מקור החידוש, ויצרה צורות חדשות ו מינים חדשים, באופן פוטנציאלי,[108] בקפיצה פתאומית.[109] זה נחזה כמניע את האבולוציה, שהוגבלה על ידי היצע המוטציות.
לפני דרווין, ביולוגים בדרך כלל האמינו המלחה, אפשרות לקפיצות אבולוציוניות גדולות, כולל מיידיות speciation. לדוגמא, בשנת 1822 אטיין ג'ופרוי סן הילייר טען שמינים יכולים להיווצר על ידי טרנספורמציות פתאומיות, או מה שיקרא אחר כך מקרומוטציה.[110] דרווין התנגד להמלחה והתעקש הדרגתיות באבולוציה כ בגיאולוגיה. בשנת 1864, אלברט פון קוליקר החיה את התיאוריה של ג'פרוי.[111] בשנת 1901 ה גנטיקאי הוגו דה פריס נתן את השם "מוטציה" לצורות חדשות לכאורה שעלו לפתע בניסויים שלו על נר הלילה Oenothera lamarckiana ובעשור הראשון של המאה ה -20 מוטציה, או כפי ששמו דה פריז כינה זאת מוטציות תיאוריה,[112][108] הפך ליריב לדרוויניזם שנתמך לזמן מה על ידי גנטיקאים כולל וויליאם בייטסון,[113] תומאס האנט מורגן, ו רג'ינלד פונט.[114][108]
ההבנה של מוטציה היא מעוננת על ידי הצגת אמצע המאה העשרים על ידי המוטציונים המוקדמים על ידי תומכי ארצות הברית סינתזה מודרנית כמתנגדים לאבולוציה הדרווינית ויריביהם של בית הספר לביומטריה שטענו כי הבחירה פועלת על וריאציה רציפה. בתצוגה זו הובס המוטציה על ידי סינתזה של גנטיקה וברירה טבעית שהתחילה כביכול מאוחר יותר, בסביבות 1918, בעבודה של המתמטיקאי. רונלד פישר.[115][116][117][118] עם זאת, היישור של גנטיקה מנדלית ובחירה טבעית החל כבר בשנת 1902 עם מאמר מאת אודני יול,[119] ונבנה בעבודה תיאורטית וניסיונית באירופה ובאמריקה. למרות המחלוקת, המוטציות המוקדמות עד 1918 כבר קיבלו את הברירה הטבעית והסבירו וריאציה מתמשכת כתוצאה מכמה גנים הפועלים על אותו מאפיין, כמו גובה.[116][117]
מוטציה, יחד עם אלטרנטיבות אחרות לדרוויניזם כמו למרקיזם ו אורתוגנזה, הושלך על ידי מרבית הביולוגים כשהם ראו כי הגנטיקה והמנדל הטבעי של מנדל יכולים לעבוד בקלות; המוטציה תפסה את מקומה כמקור לשינוי הגנטי החיוני לבחירה טבעית. עם זאת, מוטציה לא נעלמה לחלוטין. בשנת 1940, ריצ'רד גולדשמידט טען שוב למפרט חד-פעמי על ידי מקרומוטציה, ותיאר את האורגניזמים שיוצרו כך "מפלצות מלאות תקווה", שזכו ללעג נרחב.[120][121] בשנת 1987, מסאטושי ניי טען במחלוקת כי לעתים קרובות האבולוציה מוגבלת במוטציות.[122] ביולוגים מודרניים כגון דגלאס ג'יי פוטוימה להסיק כי למעשה ניתן להסביר את כל טענות האבולוציה המונעות על ידי מוטציות גדולות על ידי האבולוציה הדרווינית.[123]
ראה גם
הפניות
- ^ "מוטציה | למד מדע ב- Scitable". טֶבַע. חינוך לטבע. הוחזר 24 בספטמבר 2018.
- ^ שארמה S, Javadekar SM, Pandey M, Srivastava M, Kumari R, Raghavan SC (מרץ 2015). "הומולוגיה ודרישות אנזימטיות של הצטרפות חלופית תלויה במיקרו-הומולוגיה". מוות ותאי מחלות. 6 (3): e1697. דוי:10.1038 / cddis.2015.58. PMC 4385936. PMID 25789972.
- ^ חן ג'יי, מילר BF, פוראנו AV (אפריל 2014). "תיקון של אי התאמות טבעיות יכול לגרום למוטציות ב- DNA איגוף". eLife. 3: e02001. דוי:10.7554 / elife.02001. PMC 3999860. PMID 24843013.
- ^ Rodgers K, McVey M (ינואר 2016). "תיקון מועד לטעויות של הפסקות DNA כפולות גדיל". כתב העת לפיזיולוגיה סלולרית. 231 (1): 15–24. דוי:10.1002 / jcp.25053. PMC 4586358. PMID 26033759.
- ^ א ב ברטרם JS (דצמבר 2000). "הביולוגיה המולקולרית של סרטן". היבטים מולקולריים של הרפואה. 21 (6): 167–223. דוי:10.1016 / S0098-2997 (00) 00007-8. PMID 11173079.
- ^ א ב Aminetzach YT, Macpherson JM, Petrov DA (יולי 2005). "עמידות בפני הדברה באמצעות קטיעת גנים אדפטיביים בתיווך טרנספוזיציה בדרוזופילה". מַדָע. 309 (5735): 764–7. ביבקוד:2005Sci ... 309..764A. דוי:10.1126 / science.1112699. PMID 16051794. S2CID 11640993.
- ^ Burrus V, Waldor MK (יוני 2004). "עיצוב גנום חיידקי עם אלמנטים אינטגרטיביים ומצמידים". מחקר במיקרוביולוגיה. 155 (5): 376–86. דוי:10.1016 / j.resmic.2004.01.012. PMID 15207870.
- ^ א ב Sawyer SA, Parsch J, Zhang Z, Hartl DL (אפריל 2007). "שכיחות הברירה החיובית בקרב תחליפי חומצות אמינו כמעט נייטרליות בדרוזופילה". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 104 (16): 6504–10. ביבקוד:2007PNAS..104.6504S. דוי:10.1073 / pnas.0701572104. PMC 1871816. PMID 17409186.
- ^ הייסטינגס PJ, לופסקי ג'וניור, Rosenberg SM, Ira G (אוגוסט 2009). "מנגנוני שינוי במספר העתק הגן". ביקורות טבע. גנטיקה. 10 (8): 551–64. דוי:10.1038 / nrg2593. PMC 2864001. PMID 19597530.
- ^ קרול SB, Grenier JK, Weatherbee SD (2005). מדנ"א לגיוון: גנטיקה מולקולרית והתפתחות עיצוב בעלי חיים (מהדורה שנייה). מאלדן, MA: הוצאת בלקוול. ISBN 978-1-4051-1950-4. LCCN 2003027991. OCLC 53972564.
- ^ ראש הממשלה הריסון, גרשטיין מ (מאי 2002). "לימוד גנום דרך האאונים: משפחות חלבונים, פסאודוגנים ואבולוציה של פרוטאום". כתב העת לביולוגיה מולקולרית. 318 (5): 1155–74. דוי:10.1016 / S0022-2836 (02) 00109-2. PMID 12083509.
- ^ אורנגו קליפורניה, ת'ורנטון ג'יי (יולי 2005). "משפחות חלבונים וההתפתחות שלהם - נקודת מבט מבנית". סקירה שנתית של ביוכימיה. 74: 867–900. דוי:10.1146 / annurev.biochem.74.082803.133029. PMID 15954844.
- ^ Long M, Betrán E, Thornton K, Wang W (נובמבר 2003). "מקורם של גנים חדשים: הצצות מהצעירים והזקנים". ביקורות טבע. גנטיקה. 4 (11): 865–75. דוי:10.1038 / nrg1204. PMID 14634634. S2CID 33999892.
- ^ וואנג M, Caetano-Anollés G (ינואר 2009). "המכניקה האבולוציונית של ארגון התחום בפרוטאומים ועליית המודולריות בעולם החלבונים". מִבְנֶה. 17 (1): 66–78. דוי:10.1016 / j.str.2008.11.008. PMID 19141283.
- ^ יצרנית הקשת JK (מאי 1998). "אבולוציה של ראיית צבע בחולייתנים". עַיִן. 12 (נק '3 ב'): 541–7. דוי:10.1038 / עין.1998.143. PMID 9775215. S2CID 12851209.
- ^ גרגורי TR, Hebert PD (אפריל 1999). "אפנון תוכן ה- DNA: גורמים קרובים ותוצאות אולטימטיביות". חקר הגנום. 9 (4): 317–24. דוי:10.1101 / גרם.9.4.317 (לא פעיל 10 באוקטובר 2020). PMID 10207154.CS1 maint: DOI לא פעיל החל מאוקטובר 2020 (קישור)
- ^ Hurles M (יולי 2004). "שכפול גנים: הסחר הגנומי בחלקי חילוף". ביולוגיה של PLOS. 2 (7): E206. דוי:10.1371 / journal.pbio.0020206. PMC 449868. PMID 15252449.
- ^ Liu N, Okamura K, Tyler DM, Phillips MD, Chung WJ, Lai EC (אוקטובר 2008). "האבולוציה והגיוון הפונקציונלי של גנים של מיקרו-רנ"א מהחי". מחקר תאים. 18 (10): 985–96. דוי:10.1038 / cr.2008.278. PMC 2712117. PMID 18711447.
- ^ סיפל א (אוקטובר 2009). "אלכימיה דרוויניאנית: גנים אנושיים מ- DNA שאינו מקודד". חקר הגנום. 19 (10): 1693–5. דוי:10.1101 / gr.098376.109. PMC 2765273. PMID 19797681.
- ^ ג'אנג ג'יי, וואנג X, פודלהא או (מאי 2004). "בדיקת השערת הסימון הכרומוזומלי לבני אדם ושימפנזים". חקר הגנום. 14 (5): 845–51. דוי:10.1101 / gr.1891104. PMC 479111. PMID 15123584.
- ^ אילה פי.ג'יי, Coluzzi M (מאי 2005). "מיון כרומוזומים: בני אדם, דרוזופילה ויתושים". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 102 ספקים 1 (ספקים 1): 6535–42. ביבקוד:2005PNAS..102.6535A. דוי:10.1073 / pnas.0501847102. PMC 1131864. PMID 15851677.
- ^ הרסט GD, Werren JH (אוגוסט 2001). "תפקידם של יסודות גנטיים אנוכיים באבולוציה האיקריוטית". סקירת טבע גנטיקה. 2 (8): 597–606. דוי:10.1038/35084545. PMID 11483984. S2CID 2715605.
- ^ האסלר J, סטרוב K (נובמבר 2006). "אלמנטים אלו כווסתים לביטוי גנים". מחקר על חומצות גרעין. 34 (19): 5491–7. דוי:10.1093 / nar / gkl706. PMC 1636486. PMID 17020921.
- ^ א ב ג ד אייר-ווקר א ', קייטלי פ.ד. (אוגוסט 2007). "התפלגות השפעות הכושר של מוטציות חדשות" (PDF). סקירת טבע גנטיקה. 8 (8): 610–8. דוי:10.1038 / nrg2146. PMID 17637733. S2CID 10868777. הועבר לארכיון מ המקורי (PDF) ב -4 במרץ 2016. הוחזר 6 בספטמבר 2010.
- ^ א ב קימורה מ (1983). התיאוריה הנייטרלית של האבולוציה המולקולרית. קיימברידג ', בריטניה; ניו יורק: הוצאת אוניברסיטת קיימברידג '. ISBN 978-0-521-23109-1. LCCN 82022225. OCLC 9081989.CS1 maint: ref = harv (קישור)
- ^ בוהידר HB (ינואר 2015). יסודות הפיזיקה הפולימרית והביופיזיקה המולקולרית. הוצאת אוניברסיטת קיימברידג '. ISBN 978-1-316-09302-3.
- ^ Dover GA, Darwin C (2000). מר דרווין היקר: מכתבים על התפתחות החיים וטבע האדם. הוצאת אוניברסיטת קליפורניה. ISBN 9780520227903.
- ^ טיבארנק, מישל (12 בינואר 2017). גנטיקה והתפתחות מחלות זיהומיות. אלסבייה. ISBN 9780128001530.
- ^ "סרטן נגרם בחלקו על ידי מזל רע, ממצא המחקר". הועבר בארכיון מהמקור ב -13 ביולי 2017.
- ^ ג'הא, אלוק (22 באוגוסט 2012). "אבות מבוגרים מעבירים יותר מוטציות גנטיות, כך עולה ממחקר". האפוטרופוס.
- ^ איימס, BN; שיגנאגה, חבר הכנסת; Hagen, TM (1 בספטמבר 1993). "אוקסידנטים, נוגדי חמצון ומחלות הניוון של ההזדקנות". Proc Natl Acad Sci U S A. 90 (17): 7915–22. ביבקוד:1993PNAS ... 90.7915A. דוי:10.1073 / pnas.90.17.7915. PMC 47258. PMID 8367443.
- ^ תואר ראשון במונטלונה (1998). "מוטציה, מוטגנים ותיקון DNA". www-personal.ksu.edu. הועבר לארכיון מ המקורי ב- 26 בספטמבר 2015. הוחזר 2 באוקטובר 2015.
- ^ סטיוארט GR, אודה Y, דה בור JG, גליקמן BW (מרץ 2000). "תדירות מוטציות וספציפיות עם הגיל בכבד, בשלפוחית השתן ובמוח של עכברים מהונדסים lacI". גנטיקה. 154 (3): 1291–300. PMC 1460990. PMID 10757770.
- ^ Kunz BA, Ramachandran K, Vonarx EJ (אפריל 1998). "ניתוח רצף DNA של מוטגנזה ספונטנית ב- Saccharomyces cerevisiae". גנטיקה. 148 (4): 1491–505. PMC 1460101. PMID 9560369.
- ^ ליבר MR (יולי 2010). "המנגנון של תיקון שבירת דנ"א כפול גדילים במסלול הצטרפות הקצה של ה- DNA הלא הומולוגי". סקירה שנתית של ביוכימיה. 79: 181–211. דוי:10.1146 / annurev.biochem.052308.093131. PMC 3079308. PMID 20192759.
- ^ נוצר מ ממ"ד 1JDG הועבר בארכיון 31 בדצמבר 2015 ב מכונת Wayback
- ^ Pfohl-Leszkowicz A, Manderville RA (ינואר 2007). "Ochratoxin A: סקירה על רעילות ומסרטן בבעלי חיים ובבני אדם". תזונה מולקולרית ומחקר מזון. 51 (1): 61–99. דוי:10.1002 / mnfr.200600137. PMID 17195275.
- ^ Kozmin S, Slezak G, Reynaud-Angelin A, Elie C, de Rycke Y, Boiteux S, Sage E (ספטמבר 2005). "קרינת UVA היא מאוד מוטגנית בתאים שאינם מסוגלים לתקן 7,8-דיהידרו-8-אוקסוגואנין ב- Saccharomyces cerevisiae". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 102 (38): 13538–43. ביבקוד:2005PNAS..10213538K. דוי:10.1073 / pnas.0504497102. PMC 1224634. PMID 16157879.
- ^ א ב Fitzgerald DM, Rosenberg SM (אפריל 2019). "מהי מוטציה? פרק בסדרה: כיצד חיידקים" מסכנים "את הסינתזה המודרנית". PLOS גנטיקה. 15 (4): e1007995. דוי:10.1371 / journal.pgen.1007995. PMC 6443146. PMID 30933985.
- ^ גלהרדו RS, הייסטינגס PJ, רוזנברג SM (1 בינואר 2007). "מוטציה כתגובת לחץ וויסות ההתפתחות". ביקורות קריטיות בביוכימיה וביולוגיה מולקולרית. 42 (5): 399–435. דוי:10.1080/10409230701648502. PMC 3319127. PMID 17917874.
- ^ Quinto-Alemany D, Canerina-Amaro A, Hernández-Abad LG, Machín F, Romesberg FE, Gil-Lamaignere C (31 ביולי 2012). Sturtevant J (עורך). "שמרים רוכשים עמידות משנית לטיפול תרופתי נגד פטריות על ידי מוטגנזה אדפטיבית". PLOS ONE. 7 (7): e42279. ביבקוד:2012PLoSO ... 742279 ש. דוי:10.1371 / journal.pone.0042279. PMC 3409178. PMID 22860105.
- ^ הפניות לתמונה נמצאות בעמוד ויקיפדיה בכתובת: Commons: קובץ: mutations בולטים.svg # הפניות.
- ^ רחמן, נזנין. "ההשפעה הקלינית של רצף ה- DNA משתנה". יוזמה לשינוי הרפואה הגנטית. הועבר לארכיון מ המקורי ב -4 באוגוסט 2017. הוחזר 27 ביוני 2017.
- ^ פריז E (אפריל 1959). "ההבדל בין מוטציות מושרה ספונטניות לבסיס-אנלוגי של פאג T4". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 45 (4): 622–33. ביבקוד:1959PNAS ... 45..622F. דוי:10.1073 / pnas.45.4.622. PMC 222607. PMID 16590424.
- ^ פרייז E (יוני 1959). "ההשפעה המוטגנית הספציפית של אנלוגים בסיסיים על פאג T4". כתב העת לביולוגיה מולקולרית. 1 (2): 87–105. דוי:10.1016 / S0022-2836 (59) 80038-3.
- ^ הוגאן CM (12 באוקטובר 2010). "מוּטָצִיָה". במונוסון ה '(עורך). אנציקלופדיה של כדור הארץ. וושינגטון הבירה: קואליציית מידע סביבתי, המועצה הלאומית למדע וסביבה. OCLC 72808636. הועבר בארכיון מהמקור ב- 14 בנובמבר 2015. הוחזר 8 באוקטובר 2015.
- ^ Boillée S, Vande Velde C, Cleveland DW (אוקטובר 2006). "ALS: מחלה של נוירונים מוטוריים ושכניהם הלא עצביים". עֲצָבוֹן. 52 (1): 39–59. CiteSeerX 10.1.1.325.7514. דוי:10.1016 / j.neuron.2006.09.018. PMID 17015226. S2CID 12968143.
- ^ Steenhuysen J (19 בדצמבר 2017). "ארה"ב מרימה מימון על איסור על מחקרים המשפרים חיידקים מסוכנים". חדשות ארה"ב ודיווח עולמי. הוחזר 15 בינואר 2018.
- ^ קולינס, פרנסיס ס '(19 בדצמבר 2017). "הפסקה במימון מעליות של NIH על מחקר על השגת תפקוד". המכונים הלאומיים לבריאות. הועבר בארכיון מהמקור ב- 22 בדצמבר 2017.
- ^ גו AM, Coffill CR, ליין DP (ינואר 2011). "תפקידו של מוטציה p53 בסרטן אנושי". כתב העת לפתולוגיה. 223 (2): 116–26. דוי:10.1002 / path.2784. PMID 21125670. S2CID 23998813.
- ^ Chenevix-Trench G, Spurdle AB, Gatei M, Kelly H, Marsh A, Chen X, Donn K, Cummings M, Nyholt D, Jenkins MA, Scott C, Pupo GM, Dörk T, Bendix R, Kirk J, Tucker K, McCredie MR, Hopper JL, Sambrook J, Mann GJ, Khanna KK (פברואר 2002). "מוטציות כספומט שליליות דומיננטיות במשפחות סרטן השד". כתב העת של המכון הלאומי לסרטן. 94 (3): 205–15. CiteSeerX 10.1.1.557.6394. דוי:10.1093 / jnci / 94.3.205. PMID 11830610.
- ^ פז-פריאל הראשון, פרידמן א '(2011). "ויסות C / EBPα ב- AML ו- ALL". ביקורות קריטיות באונקוגנזה. 16 (1–2): 93–102. דוי:10.1615 / critrevoncog.v16.i1-2.90. PMC 3243939. PMID 22150310.
- ^ Capaccio D, Ciccodicola A, Sabatino L, Casamassimi A, Pancione M, Fucci A, Febbraro A, Merlino A, Graziano G, Colantuoni V (יוני 2010). "מוטציה חדשה של קו הנבט בגן גמא של קולטן המופעל על ידי פרוליזור הקשורה להיווצרות פוליפ במעי הגס ולדיסליפידמיה". Biochimica et Biophysica Acta (BBA) - בסיס מולקולרי של מחלה. 1802 (6): 572–81. דוי:10.1016 / j.bbadis.2010.01.012. PMID 20123124.
- ^ מקוסיק וי.איי (יולי 1991). "הפגם בתסמונת מרפן". טֶבַע. 352 (6333): 279–81. ביבקוד:1991 Natur.352..279 מ '. דוי:10.1038 / 352279a0. PMID 1852198. S2CID 4341743.
- ^ השופט DP, Biery NJ, Keene DR, Geubtner J, Myers L, Huso DL, Sakai LY, Dietz HC (יולי 2004). "עדות לתרומה קריטית של תסמונת הפלואינסופין בפתוגנזה המורכבת של תסמונת מרפן". כתב העת לחקירה קלינית. 114 (2): 172–81. דוי:10.1172 / JCI20641. PMC 449744. PMID 15254584.
- ^ השופטת DP, דיץ HC (דצמבר 2005). "תסמונת מרפן". אִזְמֵל. 366 (9501): 1965–76. דוי:10.1016 / S0140-6736 (05) 67789-6. PMC 1513064. PMID 16325700.
- ^ אליס NA, Ciocci S, גרמני J (פברואר 2001). "מוטציה בגב יכולה לייצר היפוך של פנוטיפ בתאים סומטיים של תסמונת בלום". גנטיקה אנושית. 108 (2): 167–73. דוי:10.1007 / s004390000447. PMID 11281456. S2CID 22290041.
- ^ צ'רלסוורת 'ד, צ'רלסוורת 'ב, מורגן MT (דצמבר 1995). "הדפוס של וריאציה מולקולרית ניטרלית תחת מודל בחירת הרקע". גנטיקה. 141 (4): 1619–32. PMC 1206892. PMID 8601499.
- ^ Loewe L (אפריל 2006). "כימות פרדוקס הריקבון הגנומי עקב המחגר של מולר ב- DNA מיטוכונדריאלי אנושי". מחקר גנטי. 87 (2): 133–59. דוי:10.1017 / S0016672306008123. PMID 16709275.
- ^ ברנשטיין H, Hopf FA, Michod RE (1987). "הבסיס המולקולרי של התפתחות המין". גנטיקה מולקולרית של התפתחות. התקדמות בגנטיקה. 24. עמ '323–70. דוי:10.1016 / s0065-2660 (08) 60012-7. ISBN 9780120176243. PMID 3324702.
- ^ פק JR, Barreau G, Heath SC (אפריל 1997). "גנים לא מושלמים, מוטציה של פישראן והתפתחות המין". גנטיקה. 145 (4): 1171–99. PMC 1207886. PMID 9093868.
- ^ סימצ'יקובה ד ', הנברג פ' (דצמבר 2019). "חידוד תחזיות הרפואה האבולוציונית המבוססות על עדויות קליניות לביטויים של מחלות מנדלניות". דוחות מדעיים. 9 (1): 18577. ביבקוד:2019 NatSR ... 918577S. דוי:10.1038 / s41598-019-54976-4. PMC 6901466. PMID 31819097.
- ^ קייטלי פ.ד., לינץ 'מ (מרץ 2003). "לקראת מודל מציאותי של מוטציות המשפיעות על הכושר הגופני". אבולוציה; כתב העת הבינלאומי להתפתחות אורגנית. 57 (3): 683–5, דיון 686–9. דוי:10.1554 / 0014-3820 (2003) 057 [0683: tarmom] 2.0.co; 2. JSTOR 3094781. PMID 12703958.
- ^ ברטון NH, Keightley PD (ינואר 2002). "הבנת וריאציה גנטית כמותית". סקירת טבע גנטיקה. 3 (1): 11–21. דוי:10.1038 / nrg700. PMID 11823787. S2CID 8934412.
- ^ א ב ג Sanjuán R, Moya A, Elena SF (יוני 2004). "התפלגות השפעות הכושר הנגרמות כתוצאה מהחלפות חד-נוקלאוטידים בנגיף RNA". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 101 (22): 8396–401. ביבקוד:2004PNAS..101.8396S. דוי:10.1073 / pnas.0400146101. PMC 420405. PMID 15159545.
- ^ Carrasco P, de la Iglesia F, Elena SF (דצמבר 2007). "התפלגות השפעות הכושר והארס הנגרמות על ידי תחליפים חד-נוקלאוטידים בנגיף חרוט הטבק". כתב העת לווירולוגיה. 81 (23): 12979–84. דוי:10.1128 / JVI.00524-07. PMC 2169111. PMID 17898073.
- ^ סנג'ואן ר '(יוני 2010). "השפעות כושר מוטציה ב- RNA ובנגיפי DNA חד-גדילי: דפוסים נפוצים שנחשפו על ידי מחקרי מוטגנזה מכוונים לאתר". עסקאות פילוסופיות של החברה המלכותית בלונדון. סדרה ב ', מדעים ביולוגיים. 365 (1548): 1975–82. דוי:10.1098 / rstb.2010.0063. PMC 2880115. PMID 20478892.
- ^ פריס JB, דייוויס P, Cuevas JM, Nebot MR, Sanjuán R (יוני 2010). "התפלגות השפעות כושר הנגרמות כתוצאה מהחלפות חד-נוקלאוטידים בבקטריופאג f1". גנטיקה. 185 (2): 603–9. דוי:10.1534 / גנטיקה. 110.115162. PMC 2881140. PMID 20382832.
- ^ אלנה SF, Ekunwe L, Hajela N, Oden SA, לנסקי רי (מרץ 1998). "הפצה של השפעות כושר הנגרמות על ידי מוטציות הכנסה אקראיות ב- Escherichia coli". גנטיקה. 102–103 (1–6): 349–58. דוי:10.1023 / ת: 1017031008316. PMID 9720287. S2CID 2267064.
- ^ א ב Hietpas RT, Jensen JD, Bolon DN (מאי 2011). "תאורה ניסיונית של נוף כושר". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 108 (19): 7896–901. ביבקוד:2011PNAS..108.7896H. דוי:10.1073 / pnas.1016024108. PMC 3093508. PMID 21464309.
- ^ דייויס EK, פיטרס AD, Keightley PD (ספטמבר 1999). "תדירות גבוהה של מוטציות מזיקות סתמיות ב- Caenorhabditis elegans". מַדָע. 285 (5434): 1748–51. דוי:10.1126 / science.285.5434.1748. PMID 10481013.
- ^ Loewe L, Charlesworth B (ספטמבר 2006). "להסיק את התפלגות ההשפעות המוטציות על הכושר בדרוזופילה". מכתבי ביולוגיה. 2 (3): 426–30. דוי:10.1098 / rsbl.2006.0481. PMC 1686194. PMID 17148422.
- ^ אייר-ווקר א ', וולפיט M, פלפס טי (יוני 2006). "התפלגות השפעות הכושר של מוטציות חדשות של חומצות אמינו מזיקות בבני אדם". גנטיקה. 173 (2): 891–900. דוי:10.1534 / גנטיקה. 106.057570. PMC 1526495. PMID 16547091.
- ^ סוייר SA, Kulathinal RJ, CD Bustamante, הרטל DL (אוגוסט 2003). "ניתוח בייזיאני מצביע על כך שרוב ההחלפות של חומצות אמינו בדרוזופילה מונעות על ידי בחירה חיובית". כתב העת לאבולוציה מולקולרית. 57 ספקים 1 (1): S154–64. ביבקוד:2003JMolE..57S.154S. CiteSeerX 10.1.1.78.65. דוי:10.1007 / s00239-003-0022-3. PMID 15008412. S2CID 18051307.
- ^ פיגאנו ג'י, אייר-ווקר א '(ספטמבר 2003). "הערכת התפלגות השפעות הכושר מנתוני רצף ה- DNA: השלכות על השעון המולקולרי". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 100 (18): 10335–40. ביבקוד:2003PNAS..10010335P. דוי:10.1073 / pnas.1833064100. PMC 193562. PMID 12925735.
- ^ קימורה מ (פברואר 1968). "קצב אבולוציוני ברמה המולקולרית". טֶבַע. 217 (5129): 624–6. ביבקוד:1968 טבע 2117..624K. דוי:10.1038 / 217624a0. PMID 5637732. S2CID 4161261.
- ^ אקשי ה '(ספטמבר 1999). "וריאציה של רצף DNA בין המינים ו"טביעת הרגל" של הברירה הטבעית ". גֵן. 238 (1): 39–51. דוי:10.1016 / S0378-1119 (99) 00294-2. PMID 10570982.
- ^ אייר-ווקר א '(אוקטובר 2006). "הקצב הגנומי של האבולוציה ההסתגלותית". מגמות באקולוגיה ואבולוציה. 21 (10): 569–75. דוי:10.1016 / j.tree.2006.06.015. PMID 16820244.
- ^ גילספי ג'יי (ספטמבר 1984). "אבולוציה מולקולרית על פני הנוף המוטציה". אבולוציה. 38 (5): 1116–1129. דוי:10.2307/2408444. JSTOR 2408444. PMID 28555784.
- ^ אור HA (אפריל 2003). "התפלגות השפעות הכושר בין מוטציות מועילות". גנטיקה. 163 (4): 1519–26. PMC 1462510. PMID 12702694.
- ^ Kassen R, Bataillon T (אפריל 2006). "התפלגות השפעות הכושר בין מוטציות מועילות לפני הבחירה באוכלוסיות ניסיוניות של חיידקים". גנטיקה טבעית. 38 (4): 484–8. דוי:10.1038 / ng1751. PMID 16550173. S2CID 6954765.
- ^ Rokyta DR, Joyce P, Caudle SB, Wichman HA (אפריל 2005). "מבחן אמפירי של מודל הנוף המוטציה של הסתגלות באמצעות נגיף DNA חד גדילי". גנטיקה טבעית. 37 (4): 441–4. דוי:10.1038 / ng1535. PMID 15778707. S2CID 20296781.
- ^ Imhof M, Schlotterer C (ינואר 2001). "השפעות כושר של מוטציות מועילות באוכלוסיות אשריכיה קולי מתפתחות". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 98 (3): 1113–7. ביבקוד:2001PNAS ... 98.1113I. דוי:10.1073 / pnas.98.3.1113. PMC 14717. PMID 11158603.
- ^ א ב "מוטציה גנטית של תאים סומטיים". מילון הגנום. אתונה, יוון: עמיתים לטכנולוגיות מידע. 30 ביוני 2007. הועבר לארכיון מ המקורי ב- 24 בפברואר 2010. הוחזר 6 ביוני 2010.
- ^ "הטרוזיגוטה מורכבת". MedTerms. ניו יורק: WebMD. 14 ביוני 2012. הועבר לארכיון מ המקורי ב -4 במרץ 2016. הוחזר 9 באוקטובר 2015.
- ^ "RB1 גנטיקה ". הקרן לסרטן העיניים של דייזי. אוקספורד, בריטניה. הועבר לארכיון מ המקורי ב- 26 בנובמבר 2011. הוחזר 9 באוקטובר 2015.
- ^ "מוטציה סומטית | גנטיקה". אנציקלופדיה בריטניקה. הועבר בארכיון מהמקור ב- 31 במרץ 2017. הוחזר 31 במרץ 2017.
- ^ הרטל DL, ג'ונס EW (1998). עקרונות גנטיקה וניתוח. סודברי, מסצ'וסטס: הוצאת ג'ונס וברטלט. עמ.556. ISBN 978-0-7637-0489-6.
- ^ Milholland B, Dong X, Zhang L, Hao X, Suh Y, Vijg J (2017). "ההבדלים בין שיעורי המוטציה הנמטרית לבין המוטציה הסומטית בבני אדם ובעכברים". נאט קומון. 8: 15183. ביבקוד:2017NatCo ... 815183M. דוי:10.1038 / ncomms15183. PMC 5436103. PMID 28485371.
- ^ אלברטס (2014). ביולוגיה מולקולרית של התא (מהדורה 6). מדע גרלנד. עמ ' 487. ISBN 9780815344322.
- ^ א ב Chadov BF, Fedorova NB, Chadova EV (1 ביולי 2015). "מוטציות מותנות בתסיסנית מלנו-גסטר: לרגל 150 שנה לדו"ח של ג. מנדל בברון". מחקר מוטציה / ביקורות במחקר מוטציה. 765: 40–55. דוי:10.1016/j.mrrev.2015.06.001. PMID 26281767.
- ^ א ב Landis G, Bhole D, Lu L, Tower J (July 2001). "High-frequency generation of conditional mutations affecting Drosophila melanogaster development and life span". גנטיקה. 158 (3): 1167–76. PMC 1461716. PMID 11454765. הועבר לארכיון מ המקורי ב- 22 במרץ 2017. הוחזר 21 במרץ 2017.
- ^ א ב ג ד Gierut JJ, Jacks TE, Haigis KM (April 2014). "Strategies to achieve conditional gene mutation in mice". פרוטוקולי נמל קולד ספרינג. 2014 (4): 339–49. דוי:10.1101/pdb.top069807. PMC 4142476. PMID 24692485.
- ^ Spencer DM (May 1996). "Creating conditional mutations in mammals". מגמות בגנטיקה. 12 (5): 181–7. דוי:10.1016/0168-9525(96)10013-5. PMID 8984733.
- ^ Tan G, Chen M, Foote C, Tan C (September 2009). "Temperature-sensitive mutations made easy: generating conditional mutations by using temperature-sensitive inteins that function within different temperature ranges". גנטיקה. 183 (1): 13–22. דוי:10.1534/genetics.109.104794. PMC 2746138. PMID 19596904.
- ^ den Dunnen JT, Antonarakis SE (ינואר 2000). "הרחבות של שמות מוטציה והצעות לתיאור מוטציות מורכבות: דיון". מוטציה אנושית. 15 (1): 7–12. דוי:10.1002 / (SICI) 1098-1004 (200001) 15: 1 <7 :: AID-HUMU4> 3.0.CO; 2-N. PMID 10612815.
- ^ Jónsson, Hákon; סולם, פטריק; Kehr, Birte; Kristmundsdottir, Snaedis; Zink, Florian; Hjartarson, Eirikur; Hardarson, Marteinn T.; Hjorleifsson, Kristjan E.; Eggertsson, Hannes P.; Gudjonsson, Sigurjon Axel; Ward, Lucas D. (September 2017). "Parental influence on human germline de novo mutations in 1,548 trios from Iceland". טֶבַע. 549 (7673): 519–522. ביבקוד:2017Natur.549..519J. דוי:10.1038/nature24018. ISSN 1476-4687. PMID 28959963. S2CID 205260431.
- ^ Doniger SW, Kim HS, Swain D, Corcuera D, Williams M, Yang SP, Fay JC (August 2008). פריצ'רד ג'יי קיי (עורך). "A catalog of neutral and deleterious polymorphism in yeast". PLOS גנטיקה. 4 (8): e1000183. דוי:10.1371/journal.pgen.1000183. PMC 2515631. PMID 18769710.
- ^ Ionov Y, Peinado MA, Malkhosyan S, Shibata D, Perucho M (June 1993). "Ubiquitous somatic mutations in simple repeated sequences reveal a new mechanism for colonic carcinogenesis". טֶבַע. 363 (6429): 558–61. ביבקוד:1993Natur.363..558I. דוי:10.1038/363558a0. PMID 8505985. S2CID 4254940.
- ^ Araten DJ, Golde DW, Zhang RH, Thaler HT, Gargiulo L, Notaro R, Luzzatto L (September 2005). "A quantitative measurement of the human somatic mutation rate". מחקר הסרטן. 65 (18): 8111–7. דוי:10.1158/0008-5472.CAN-04-1198. PMID 16166284.
- ^ "'Lifeless' prion proteins are 'capable of evolution'". בְּרִיאוּת. חדשות ה - BBC. לונדון. 1 בינואר 2010. הועבר בארכיון מהמקור ב- 25 בספטמבר 2015. הוחזר 10 באוקטובר 2015.
- ^ Sullivan AD, Wigginton J, Kirschner D (August 2001). "The coreceptor mutation CCR5Delta32 influences the dynamics of HIV epidemics and is selected for by HIV". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 98 (18): 10214–9. ביבקוד:2001PNAS...9810214S. דוי:10.1073/pnas.181325198. PMC 56941. PMID 11517319.
- ^ "תעלומת המוות השחור". סודות המתים. Season 3. Episode 2. 30 October 2002. PBS. הועבר בארכיון מהמקור ב- 12 באוקטובר 2015. הוחזר 10 באוקטובר 2015. Episode background.
- ^ Galvani AP, Slatkin M (דצמבר 2003). "הערכת מגיפה ואבעבועות שחורות כלחצים סלקטיביים היסטוריים עבור אלל העמידות ל- HIV מסוג CCR5-Delta 32". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 100 (25): 15276–9. ביבקוד:2003PNAS..10015276G. דוי:10.1073 / pnas.2435085100. PMC 299980. PMID 14645720.
- ^ Konotey-Ahulu F. "Frequently Asked Questions [FAQ's]". sicklecell.md. הועבר לארכיון מ המקורי ב- 30 באפריל 2011. הוחזר 16 באפריל 2010.
- ^ Hughes D, Andersson DI (September 2017). "Evolutionary Trajectories to Antibiotic Resistance". סקירה שנתית של מיקרוביולוגיה. 71: 579–596. דוי:10.1146/annurev-micro-090816-093813. PMID 28697667.
- ^ Ségurel L, Bon C (אוגוסט 2017). "על האבולוציה של התמדה לקטז בבני אדם". סקירה שנתית של גנומיקה וגנטיקה אנושית. 18: 297–319. דוי:10.1146 / annurev-genom-091416-035340. PMID 28426286.
- ^ א ב ג באולר PJ (1992) [1983]. The Eclipse of Darwinism. עמ ' 198.
- ^ Smocovitis VB (1996). "Unifying biology: the evolutionary synthesis and evolutionary biology". כתב העת להיסטוריה של הביולוגיה. הוצאת אוניברסיטת פרינסטון. 25 (1): 1–65. דוי:10.1007/bf01947504. ISBN 978-0-691-03343-3. LCCN 96005605. OCLC 34411399. PMID 11623198. S2CID 189833728.
- ^ Hallgrímsson B, Hall BK (2011). וריאציה: מושג מרכזי בביולוגיה. העיתונות האקדמית. עמ ' 18.
- ^ סוואל רייט. (1984). אבולוציה וגנטיקה של אוכלוסיות: גנטיקה ויסודות ביומטריים כרך 1. הוצאת אוניברסיטת שיקגו. עמ ' 10
- ^ De Vries H (1905). Species and Varieties: Their Origin by Mutation.
- ^ Bateson W (1894). Materials for the Study of Variation, Treated with Especial Regard to Discontinuity in the Origin of Species.
- ^ Punnett RC (1915). חיקוי בפרפרים. הוצאת אוניברסיטת קיימברידג '.
- ^ Mayr E (2007). מה מייחד את הביולוגיה?: שיקולים על האוטונומיה של משמעת מדעית. הוצאת אוניברסיטת קיימברידג '.
- ^ א ב פרובינציה WB (2001). מקורותיה של גנטיקת אוכלוסייה תיאורטית, עם מילה חדשה. הוצאת אוניברסיטת שיקגו, שיקגו. עמ '56–107.
- ^ א ב סטולצפוס A, כבל K (2014). "מנדלני-מוטציה: הסינתזה האבולוציונית הנשכחת". כתב העת להיסטוריה של הביולוגיה. 47 (4): 501–46. דוי:10.1007 / s10739-014-9383-2. PMID 24811736. S2CID 23263558.
- ^ האל DL (1985). "דרוויניזם כישות היסטורית: הצעה היסטוריוגרפית". בקוהן ד '(עורך). המורשת הדרווינית. הוצאת אוניברסיטת פרינסטון. עמ.773–812.
- ^ יול GU (1902). "חוקי מנדל ויחסיהם האפשריים לתורשה בין-גזעית". פיטולוג חדש. 1 (10): 226–227. דוי:10.1111 / j.1469-8137.1902.tb07336.x.
- ^ Gould SJ (1982). השימושים בכפירה; מבוא לריצ'רד גולדשמידט הבסיס החומרי של האבולוציה. הוצאת אוניברסיטת ייל. עמ 'קסיי-קסלי. ISBN 0300028237.
- ^ Ruse M (1996). מונאד לאדם: מושג ההתקדמות בביולוגיה אבולוציונית. הוצאת אוניברסיטת הרווארד. עמ.412–413. ISBN 978-0-674-03248-4.
- ^ סטולצפוס A (2014). "בחיפוש אחר אבולוציה מונעת מוטציה". אבולוציה ופיתוח. 16: 57–59. דוי:10.1111 / ede.12062.
- ^ תקליטן Futuyma (2015). Serrelli E, Gontier N (עורכים). האם תורת האבולוציה המודרנית יכולה להסביר מאקרו-התפתחות? (PDF). התפתחות מקרו. ספרינגר. עמ '29–85.
קישורים חיצוניים
- ג'ונס ס וולפסון א ' פרטרידג 'ל (6 בדצמבר 2007). "מוטציה גנטית". בזמננו. רדיו BBC 4. הוחזר 18 באוקטובר 2015.
- ליו, סטפני (5 בפברואר 2011). "הכל על מוטציות". תקוות. פרויקט החינוך של הנטינגטון לחינוך בסטנפורד. הוחזר 18 באוקטובר 2015.
- "מאגרי מוטציה ספציפיים למיקום". ליידן, הולנד: המרכז הרפואי של אוניברסיטת ליידן. הוחזר 18 באוקטובר 2015.
- "ברוך הבא לאתר Mutalyzer". ליידן, הולנד: המרכז הרפואי של אוניברסיטת ליידן. הוחזר 18 באוקטובר 2015. - ה מאטליזר אתר אינטרנט.




