
תַעֲתוּק הוא הראשון מבין מספר השלבים של DNA מבוסס ביטוי גנים בו מועתק קטע מסוים של DNA RNA (במיוחד mRNA ) דרך אֶנזִים RNA פולימראז.
גם ה- DNA וגם ה- RNA הם חומצות גרעין, אשר משתמשים זוגות בסיסים שֶׁל נוקלאוטידים כ מַשׁלִים שפה. במהלך השעתוק, קוראים רצף DNA על ידי פולימראז RNA, המייצר משלים, אנטי מקבילית גדיל RNA הנקרא a תמליל ראשוני.
תמלול ממשיך בשלבים כלליים הבאים:
- RNA פולימראז, יחד עם אחד או יותר גורמי שעתוק כלליים, נקשר ל DNA מקדם.
- RNA פולימראז מייצר a בועת תמלול, המפריד בין שני גדילי סליל ה- DNA. זה נעשה על ידי שבירת ה- קשרי מימן בין נוקלאוטידים משלימים של ה- DNA.
- RNA פולימראז מוסיף RNA נוקלאוטידים (המשלימים לנוקליאוטידים של גדיל DNA אחד).
- צורות עמוד השדרה של סוכר פוספט ב- RNA בעזרת פולימראז של RNA ליצירת גדיל RNA.
- קשרי מימן של סליל ה- RNA – DNA נשברים, ומשחררים את גדיל ה- RNA המסונתז לאחרונה.
- אם בתא יש גַרעִין, ה- RNA עשוי להיות מעובד יותר. זה עשוי לכלול polyadenylation, מכסת, ו שחבור.
- ה- RNA עשוי להישאר בגרעין או ביציאה אל ה- ציטופלזמה דרך ה נקבוביות גרעיניות מורכב.
קטע ה- DNA המתועתק למולקולת RNA נקרא a יחידת תמלול ומקודד לפחות אחד גֵן. אם הגן מקודד a חֶלְבּוֹן, התמלול מייצר שליח RNA (mRNA); ה- mRNA, בתורו, משמש תבנית לסינתזת החלבון באמצעותו תִרגוּם. לחלופין, הגן המועתק עשוי לקודד עבור RNA שאינו מקודד כמו microRNA, RNA ריבוזומלי (rRNA), העברת RNA (tRNA), או מולקולות RNA אנזימטיות הנקראות ריבוזימים.[1] בסך הכל, RNA מסייע בסינתזה, ויסות ועיבוד חלבונים; לכן הוא ממלא תפקיד מהותי בביצוע פונקציות בתוך a תָא.
ב וירולוגיה, ניתן להשתמש במונח גם כאשר מתייחסים לסינתזת mRNA ממולקולת RNA (כלומר שכפול RNA). למשל, גנום של שלילי-לָחוּשׁ נגיף חד-גדילי (ssRNA -) עשוי להיות תבנית ל- RNA חד-גדילי בעל חוש חיובי (ssRNA +)[יש צורך בבירור ]. הסיבה לכך היא שחוט החוש החיובי מכיל את המידע הדרוש לתרגום החלבונים הנגיפיים עבורם שכפול ויראלי לאחר מכן. תהליך זה מזרז על ידי ויראלי רפליקציה של RNA.[2][יש צורך בבירור ]
רקע כללי
יחידת תעתיק DNA המקודדת לחלבון עשויה להכיל את שניהם a רצף קידוד, אשר יתורגם לחלבון, ו- רצפים רגולטוריים, המכוונים ומווסתים את הסינתזה של אותו חלבון. הרצף הרגולטורי לפני ("בְּמַעֲלֶה הַזֶרֶם "מ) רצף הקידוד נקרא חמש אזורים לא מתורגמים ראשוניים (5'UTR); הרצף אחרי ("בְּמוֹרַד הַזֶרֶם "מ) רצף הקידוד נקרא שלושה אזורים ראשונים שלא הועברו (3'UTR).[1]
בניגוד ל שכפול הדנ"א תוצאה של תעתיק היא השלמת RNA הכוללת את הנוקלאוטיד אורציל (U) בכל המקרים שבהם תימין (T) היה מתרחש בתוסף DNA.
רק אחת משתי גדילי ה- DNA משמשת תבנית לתעתיק. ה אנטיסנס קווצת DNA נקראת על ידי RNA פולימראז מקצה 3 'לקצה 5' במהלך תעתיק (3 '→ 5'). ה- RNA המשלים נוצר בכיוון ההפוך, בכיוון 5 '→ 3', ומתאים לרצף של גדיל החישה למעט החלפת אורציל לתימין. כיווניות זו היא מכיוון ש- RNA פולימראז יכול להוסיף רק נוקליאוטידים לקצה 3 'של שרשרת ה- mRNA ההולכת וגדלה. שימוש זה רק בגדיל ה- DNA 3 '→ 5' מבטל את הצורך ב- שברי אוקאזאקי שנראים בשכפול DNA.[1] זה גם מסיר את הצורך ב- פריימר RNA ליזום סינתזת RNA, כפי שקורה בשכפול DNA.
ה לֹא- גדיל תבנית (חוש) של DNA נקרא גדיל קידוד, מכיוון שהרצף שלו זהה לתמליל ה- RNA החדש שנוצר (למעט החלפת uracil בתימין). זהו החוט המשמש את הקונבנציה בעת הצגת רצף DNA.[3]
לתעתיק יש כמה מנגנוני הגהה, אך הם פחות ופחות יעילים מהבקרות להעתקת DNA. כתוצאה מכך, לתעתיק יש אמינות העתקה נמוכה יותר מאשר שכפול DNA.[4]
צעדים עיקריים
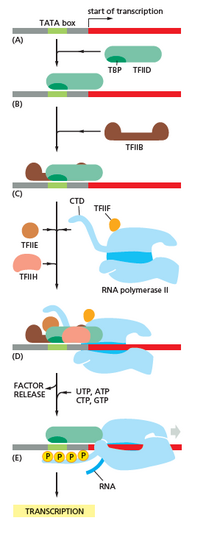
תמלול מחולק ל חניכה, הימלטות היזם, הַאֲרָכָה, ו סיום.[5]
חניכה
תעתיק מתחיל בקשירה של RNA פולימראז, יחד עם אחד או יותר גורמי שעתוק כלליים, לרצף DNA ספציפי המכונה "מְקַדֵם "ליצירת מקדם RNA פולימראז" מורכב סגור ". ב"מתחם הסגור" ה- DNA של היזם עדיין גדיל כפול.[5]
RNA פולימראז, הנעזר בגורם שעתוק כללי אחד או יותר, ואז מסיר כ- 14 זוגות בסיס של DNA ליצירת "קומפלקס פתוח" של מקדם RNA פולימראז. ב"מתחם הפתוח "ה- DNA של היזם חלקית לא מפותל וחד-גדילי. ה- DNA החשוף החד-גדילי מכונה "בועת התעתיק".[5]
RNA פולימראז, נעזר בגורם שעתוק כללי אחד או יותר, ואז בוחר a אתר התחלת תמלול בבועת התעתיק, נקשר ליוזם NTP והארכה NTP (או RNA קצר תֶחֶל ו- NTP מאריך) המשלים לרצף אתר התחלת השעתוק, ומזרז יצירת קשרים להניב מוצר RNA ראשוני.[5]
ב בַּקטֶרִיָה, RNA פולימראז הולואנזים מורכב מחמש יחידות משנה: 2 יחידות α, יחידת משנה 1 β, יחידת משנה 1 β ו- 1 יחידת משנה. בחיידקים קיים גורם כללי אחד של תעתיק RNA המכונה a גורם סיגמא. אנזים ליבת פולימראז של RNA נקשר לגורם שעתוק כללי של חיידקים (סיגמה) ליצירת הולואנזים של RNA פולימראז ואז נקשר למקדם.[5](RNA פולימראז נקרא הולואנזים כאשר יחידת משנה סיגמא מחוברת לאנזים הליבה המורכב מ -2 יחידות משנה α, יחידת משנה 1 β, יחידת משנה 1 β בלבד).
ב ארכאה ו אוקריוטים, RNA פולימראז מכיל יחידות משנה הומולוגי לכל אחת מחמשת יחידות ה- RNA פולימראז בחיידקים ומכיל גם יחידות משנה נוספות. בארכאיים ובאאוקריוטים, הפונקציות של גורם השעתוק הכללי של חיידקי סיגמה מבוצעות על ידי מספר גורמי תעתוק כלליים העובדים יחד.[5] בארכאיים ישנם שלושה גורמי תעתיק כלליים: TBP, TFB, ו TFE. באיקריוטים, ב RNA פולימראז II תעתיק תלוי, ישנם שישה גורמי תמלול כלליים: TFIIA, TFIIB (an אורתולוג של TFB ארכיאאלי), TFIID (גורם רב-יחידתי שבו יחידת המשנה המרכזית, TBP, הוא אורתולוג של TBP ארכיאאלי), TFIIE (an אורתולוג של TFE ארכיאלי), TFIIF, ו TFIIH. ה- TFIID הוא המרכיב הראשון שנקשר ל- DNA עקב קשירת TBP, ואילו TFIIH הוא המרכיב האחרון שגויס. בארכאה ובאאוקריוטים, המתחם הסגור מקדם ה- RNA פולימראז מכונה בדרך כלל "מתחם קדם ראשוני."[6]
ייזום תמלול מווסת על ידי חלבונים נוספים, המכונים מפעילים ו מדכאים, ובמקרים מסוימים קשורים מקדמי פעולה אוֹ מדכאי דם, המווסתים את היווצרותם ותפקודם של מתחם ייזום התמלול.[5]
בורח היזם
לאחר הסינתזה של הקשר הראשון, על פולימראז ה- RNA להימלט מהמקדם. במהלך תקופה זו יש נטייה לשחרר את תמליל ה- RNA ולהפיק תמלילים קטומים. זה נקרא חניכה הפלה, והוא נפוץ הן באיקריוטים והן בפרוקריוטים.[7] ייזום הפלה ממשיך להתרחש עד שמסונתז תוצר של RNA באורך סף של כ -10 נוקלאוטידים, בשלב זה מתרחשת בריחת האמרגן ונוצר מתחם התארכות תעתיק.
מבחינה מכנית, בריחת האמרגן מתרחשת דרך שריטת DNA, המספקת את האנרגיה הדרושה לשבירת האינטראקציות בין RNA פולימראז הולואנזים לבין האמרגן.[8]
בחיידקים סברו כי ה גורם סיגמא בהחלט משוחרר לאחר אישור היזם. תיאוריה זו נודעה בשם מודל שחרור מחייב. עם זאת, נתונים מאוחרים יותר הראו כי לאחר אישור האמרגן ובעקבותיו, גורם הסיגמה משתחרר על פי א מודל סטוכסטי ידוע כ דגם שחרור סטוכסטי.[9]
באאוקריוטים, במקדם תלוי RNA פולימראז II, לאחר אישור היזם, TFIIH זרחן סרין 5 בתחום הסופי של קרבוקסי של RNA פולימראז II, מה שמוביל לגיוס אנזים מכסה (CE).[10][11] המנגנון המדויק של האופן שבו CE גורם לאישור היזמים באיקריוטים עדיין לא ידוע.
הַאֲרָכָה

קווצה אחת של ה- DNA, ה- גדיל תבנית (או גדיל שאינו מקודד), משמש כתבנית לסינתזת RNA. ככל שמתקדם תעתיק, RNA פולימראז חוצה את גדיל התבנית ומשתמש בהשלמת זיווג בסיס לתבנית ה- DNA כדי ליצור עותק RNA (שמתארך במהלך המעבר). למרות ש- RNA פולימראז חוצה את גדיל התבנית מ- 3 '→ 5', ניתן להשתמש בגדיל המקודד (שאינו תבנית) ו- RNA שזה עתה נוצר כנקודות ייחוס, כך שניתן לתאר שעתוק כמתרחש 5 '→ 3' זה מייצר מולקולת RNA מ 5 '→ 3', עותק מדויק של הגדיל המקודד (חוץ מזה תימין מוחלפים ב uracils, והנוקלאוטידים מורכבים מסוכר ריבוז (5 פחמן) כאשר ל- DNA יש דאוקסיריבוז (אטום חמצן פחות) בעמוד השדרה הסוכר-פוספט שלו).[צורך בציטוט ]
תעתיק mRNA יכול לכלול מספר רב של פולימראזות RNA על תבנית DNA אחת ומספר סיבובי תעתיק (הגברה של mRNA מסוים), ולכן ניתן לייצר במהירות מולקולות mRNA רבות מעותק יחיד של גן.[צורך בציטוט ] שיעורי ההתארכות האופייניים בפרוקריוטים ובאיקריוטים הם כ- 10-100 נט / שנייה.[12] באיקריוטים, לעומת זאת, נוקלאוזומים לשמש כמחסומים עיקריים לתעתיק פולימראז במהלך התארכות התמלול.[13][14] באורגניזמים אלה, ניתן להסדיר את ההשהייה הנגרמת על ידי נוקלאוזומים על ידי גורמי התארכות שעתוק כגון TFIIS.[14]
התארכות כוללת גם מנגנון הגהה שיכול להחליף בסיסים ששולבו בצורה שגויה. באיקריוטים, זה עשוי להתכתב עם הפסקות קצרות במהלך תמלול המאפשרות לגורמי עריכת RNA מתאימים להיקשר. הפסקות אלו עשויות להיות מהותיות לפולימראז RNA או עקב מבנה הכרומטין.[צורך בציטוט ]
סיום
חיידקים משתמשים בשתי אסטרטגיות שונות לסיום תמלול - סיום בלתי תלוי ב- Rho וסיום תלוי ב- Rho. ב סיום תמלול בלתי תלוי ב- Rho, תעתיק RNA מפסיק כאשר מולקולת ה- RNA המסונתזת החדשה יוצרת עשיר ב- GC לולאת סיכת שיער ואחריו ריצה של אותנו. כאשר נוצר סיכת השיער, הלחץ המכני שובר את קשרי ה- rU-dA החלשים, וכעת הוא ממלא את הכלאה ה- DNA – RNA. זה מושך את תמליל ה- poly-U מהאתר הפעיל של ה- RNA פולימראז, ומסיים את התעתיק. בסוג הסיום "תלוי Rho", גורם חלבון הנקרא "רו "מערער את האינטראקציה בין התבנית ל- mRNA, ובכך משחרר את ה- mRNA המסונתז לאחרונה ממתחם ההתארכות.[15]
הפסקת תעתיק באאוקריוטים מובנת פחות מאשר אצל חיידקים, אך כוללת מחשוף של התמליל החדש ואחריו תוספת עצמאית של אדנינים בקצה 3 'החדש שלו, בתהליך שנקרא polyadenylation.[16]
תפקידו של RNA פולימראז בשינויים שלאחר תעתיק ב- RNA
RNA פולימראז ממלא תפקיד מכריע מאוד בכל השלבים כולל שינויים לאחר תעתיק ב- RNA.
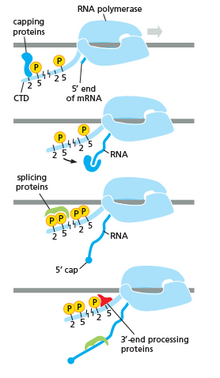
כפי שמוצג בתמונה מימין ניתן לראות ש- CTD (תחום טרמינל C) הוא זנב שמשנה את צורתו ואז זנב זה ישמש כמוביל של שחבור, מכסה ו polyadenylation. שנוכל לראות על התמונה משמאל.[17]
מעכבים
ניתן להשתמש במעכבי תמלול כ אַנְטִיבִּיוֹטִיקָה נגד, למשל, חיידקים פתוגניים (אנטיבקטריאליות ) ו פטריות (אנטי פטרייתי ). דוגמה לאנטיבקטריאלי כזה הוא ריפמפיצין, שמעכב תעתיק חיידקי של DNA ל- mRNA על ידי עיכוב תלוי DNA RNA פולימראז על ידי קשירת יחידת הבטא שלה, בעוד 8-hydroxyquinoline הוא מעכב שעתוק נגד פטריות.[18] ההשפעות של מתילציה של היסטון עשוי גם לעבוד כדי לעכב את פעולת התעתיק. מוצרים טבעיים ביו-אקטיביים חזקים כמו טריפטוליד המעכבים תעתיק יונקים באמצעות עיכוב של יחידת המשנה XPB של גורם השעתוק הכללי TFIIH דווחו לאחרונה כצמידת גלוקוז למיקוד לתאי סרטן היפוקסיים עם ביטוי מוגבר של גלוקוז.[19]
מעכבים אנדוגניים
אצל חוליות, רוב הגן מקדמים מכילים א האי CpG עם רבים אתרי CpG.[20] כאשר רבים מאתרי ה- CpG היזמים של הגן הם מתיל הגן הופך להיות מעוכב (מושתק).[21] סרטן המעי הגס כולל בדרך כלל 3 עד 6 נהג מוטציות ו- 33 עד 66 טרֶמפִּיסט או מוטציות של נוסעים.[22] עם זאת, עיכוב תעתיק (השתקה) עשוי להיות בעל חשיבות רבה יותר מאשר מוטציה בגרימת התקדמות לסרטן. לדוגמא, בסרטן המעי הגס כ 600 עד 800 גנים מעוכבים באופן תעתיק על ידי מתילציה של האי CpG (ראה ויסות תמלול בסרטן ). דיכוי תעתיק בסרטן יכול להתרחש גם על ידי אחרים אפיגנטיים מנגנונים, כגון ביטוי שונה של מיקרו רנ"א.[23] בסרטן השד, דיכוי תעתיק של BRCA1 עלול להתרחש בתדירות גבוהה יותר על ידי ביטוי יתר של ה- microRNA-182 מאשר על ידי היפר-מתילציה של האמרגן BRCA1 (ראה ביטוי נמוך של BRCA1 בסרטן השד והשחלות ).
מפעלי תמלול
יחידות תעתיק אקטיביות מקובצות בגרעין, באתרים נפרדים הנקראים מפעלי תמלול אוֹ אוכרומטין. ניתן לדמיין אתרים כאלה על ידי מתן אפשרות לפולימראזות העוסקות להאריך את תמלוליהם בקדימות מתויגות (Br-UTP או Br-U) ותיוג חיסוני של ה- RNA המתהווה המתויג. ניתן למקם מפעלי תמלול גם באמצעות קרינה פלואורסצנטית הכלאה באתרו או לסמן נוגדנים המופנים כנגד פולימראזות. ישנם ~ 10,000 מפעלים בגרעין של א תא הלה, ביניהם ~ 8,000 מפעלים פולימראז II ו -2,000 מפעלים פולימראז III. כל מפעל פולימראז II מכיל ~ 8 פולימראזות. מכיוון שרוב יחידות התעתיק הפעילות משויכות לפולימראז אחד בלבד, כל מפעל מכיל בדרך כלל ~ 8 יחידות תמלול שונות. יחידות אלה עשויות להיות משויכות באמצעות מקדמים ו / או משפרי, כאשר לולאות יוצרות "ענן" סביב הגורם.[24]
הִיסטוֹרִיָה
השערה לראשונה על מולקולה המאפשרת לממש את החומר הגנטי כחלבון פרנסואה ג'ייקוב ו ז'אק מונוד. סוורו אוצ'ואה זכה ב פרס נובל לפיזיולוגיה או לרפואה בשנת 1959 לפיתוח תהליך לסינתזת RNA בַּמַבחֵנָה עם פוספורילאז פולינוקליאוטידי, שהיה שימושי לפיצוח ה- קוד גנטי. סינתזת RNA מאת RNA פולימראז נוסד בַּמַבחֵנָה על ידי כמה מעבדות עד 1965; עם זאת, ל- RNA המסונתז על ידי אנזימים אלה היו תכונות שהצביעו על קיומו של גורם נוסף הדרוש לסיום תמלול נכון.[צורך בציטוט ]
בשנת 1972, וולטר פירס הפך לאדם הראשון שהוכיח בפועל את קיומו של האנזים המסיים.
רוג'ר קורנברג זכה ב -2006 פרס נובל לכימיה "למחקריו על הבסיס המולקולרי של תעתיק אוקריוטי ".[25]
מדידה וגילוי

ניתן למדוד ולזהות תמלול במגוון דרכים:[צורך בציטוט ]
- קלטת G-Less מבחני תמלול: מודדים את חוזק היזם
- תמלול נגר assay: מזהה אתרי התחלת שעתוק (TSS)
- הפעלה גרעינית assay: מודד את השפע היחסי של תמלילים שזה עתה נוצרו
- KAS-seq: מודד DNA חד-גדילי שנוצר על ידי פולימראזות RNA; יכול לעבוד עם 1,000 תאים.[26]
- בדיקת הגנה על RNase ו צ'יפ-צ'יפ שֶׁל RNAP: לזהות אתרי תמלול פעילים
- RT-PCR: מודד את השפע המוחלט של רמות ה- RNA הכוללות או הגרעיניות, אולם עשוי להיות שונה משיעורי התמלול
- מיקרו מערכי DNA: מודד את השפע היחסי של רמות ה- RNA הכוללות או ה- RNA הגרעיניות; עם זאת, אלה עשויים להיות שונים משיעורי התמלול
- הכלאה באתרו: מגלה נוכחות של תמליל
- תיוג MS2: על ידי שילוב RNA לולאות גזע, כגון MS2, בגן, אלה משתלבים ב- RNA שזה עתה מסונתז. לאחר מכן ניתן לאתר את לולאות הגזע באמצעות מיזוג של GFP וחלבון המעיל MS2, בעל אינטראקציה ספציפית רצופה עם זיקה גבוהה, עם לולאות הגזע MS2. גיוס ה- GFP לאתר התמלול הוא דמיין כנקודה פלואורסצנטית אחת. גישה חדשה זו גילתה כי תעתיק מתרחש בהתפרצויות או פולסים לא רציפות (ראה התפוצצות תמלול ). למעט טכניקות באתר, רוב השיטות האחרות מספקות ממוצעים של אוכלוסיית תאים ואינן מסוגלות לזהות תכונה בסיסית זו של גנים.[27]
- כתם צפוני: השיטה המסורתית, ועד הופעתה של RNA- Seq, הכי כמותי
- RNA- Seq: מחיל טכניקות רצף של הדור הבא על רצף שלם תמלול, המאפשרת מדידה של שפע יחסי של RNA, כמו גם איתור וריאציות נוספות כגון גני היתוך, עריכות לאחר תמלול ואתרי אחוי חדשים
- תא יחיד RNA-Seq: מגביר וקורא תמלילים חלקיים מתאים מבודדים, ומאפשר ניתוח מפורט של RNA ברקמות, עוברים וסרטן.
תמלול הפוך
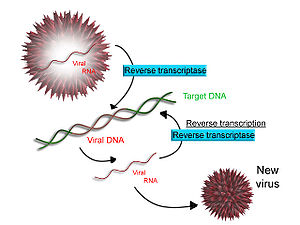
כמה וירוסים (כמו HIV, הגורם ל איידס ), יש יכולת להעתיק RNA ל- DNA. ל- HIV יש גנום RNA כלומר תמלל הפוך לתוך ה- DNA. ניתן למזג את ה- DNA שנוצר עם הגנום של ה- DNA של התא המארח. האנזים העיקרי האחראי על סינתזת ה- DNA מתבנית RNA נקרא תעתיק הפוך.
במקרה של HIV, תעתיק הפוך אחראי לסינתזה של a DNA משלים גדיל (cDNA) לגנום ה- RNA הנגיפי. האנזים ריבונוקלאז ח ואז מעכל את גדיל ה- RNA, וטרנסקריפטאז הפוך מסנתז גדיל משלים של DNA ליצירת מבנה DNA כפול של סליל ("cDNA"). ה- cDNA משולב בגנום התא המארח על ידי האנזים integrase, מה שגורם לתא המארח ליצור חלבונים נגיפיים שמתחברים מחדש לחלקיקים נגיפיים חדשים. ב- HIV, בעקבות זאת, התא המארח עובר מוות של תאים מתוכנת, או אפופטוזיס שֶׁל תאי T.[28] עם זאת, ברטרו-וירוסים אחרים, התא המארח נשאר שלם כאשר הנגיף מבצבץ מחוץ לתא.
חלק מהתאים האוקריוטים מכילים אנזים עם פעילות תעתיק הפוך הנקרא טלומראז. טלומראז הוא תעתיק הפוך שמאריך את קצות הכרומוזומים הליניאריים. הטלומרז נושא תבנית RNA שממנה הוא מסנתז רצף חוזר של DNA, או DNA "זבל". רצף חוזר זה של ה- DNA נקרא a טלומר ויכול להיחשב כ"כובע "לכרומוזום. זה חשוב מכיוון שבכל פעם שכפול כרומוזום ליניארי הוא מתקצר. עם ה- DNA "זבל" או "מכסה" זה בקצות הכרומוזומים, הקיצור מבטל חלק מהרצף החוזר שאינו חיוני ולא מרצף ה- DNA המקודד לחלבון, שנמצא רחוק יותר מקצה הכרומוזום.
טלומראז מופעל לעיתים קרובות בתאים סרטניים כדי לאפשר לתאים סרטניים לשכפל את הגנום שלהם ללא הגבלת זמן מבלי לאבד רצף DNA חשוב שמקודד חלבונים. הפעלת טלומראז יכולה להיות חלק מהתהליך המאפשר להפוך לתאים סרטניים בן אלמוות. הוכח שהגורם המנציח של סרטן באמצעות התארכות הטלומרים עקב טלומראז מופיע אצל 90% מכלל הגידולים המסרטנים. in vivo כאשר 10% הנותרים משתמשים במסלול תחזוקת טלומרים חלופי בשם ALT או התארכות חלופית של טלומרים.[29]
ראה גם
- חַיִים
- ביולוגיה של התא)
- חלוקת תא
- גֵן
- ויסות גנים
- ביטוי גנים
- אפיגנטיקה
- גנום
- הדוגמה המרכזית של קריק, שבו תוצר השעתוק, mRNA, הוא מְתוּרגָם כדי ליצור פוליפפטידים, ובמקום שנטען כי התהליכים ההפוכים לעולם אינם מתרחשים
- ויסות גנים
- RNA ארוך שאינו מקודד
- מיסרנה mRNA
- שחבור - תהליך הסרה אינטרונים מבשר ה- RNA של המבשר (טרום mRNA ) לייצר RNA שליח (mRNA )
- תעתיק
- תרגום (ביולוגיה)
הפניות
- ^ א ב ג אלדרה פ 'סולומון, לינדה ר' ברג, דיאנה וו. מרטין. ביולוגיה, מהדורה 8, מהדורת הסטודנטים הבינלאומית. תומסון ברוקס / קול. ISBN 978-0495317142
- ^ Koonin EV, Gorbalenya AE, Chumakov KM (יולי 1989). "זיהוי טנטטיבי של פולימראזות RNA תלויות RNA של נגיפי dsRNA והקשר שלהם לפולימראזות נגיפיות של RNA גדיל חיובי". מכתבי FEBS. 252 (1–2): 42–6. דוי:10.1016/0014-5793(89)80886-5. PMID 2759231. S2CID 36482110.
- ^ "גדילי DNA". www.sci.sdsu.edu. הועבר בארכיון מהמקור ב- 27 באוקטובר 2017. הוחזר 1 במאי 2018.
- ^ ברג J, טימוצ'קו JL, Stryer L (2006). בִּיוֹכִימִיָה (מהדורה 6). סן פרנסיסקו: וו. ה 'פרימן. ISBN 0-7167-8724-5.
- ^ א ב ג ד ה f ז ווטסון JD, בייקר TA, Bell SP, GAN AA, Levine M, Losick RM (2013). ביולוגיה מולקולרית של הגן (מהדורה 7). פירסון.
- ^ רודר, רוברט ג'י (1991). "המורכבויות של ייזום שעתוק איקריוטי: ויסות הרכבה מורכבת של טרום היזמה". מגמות במדעים ביוכימיים. 16 (11): 402–408. דוי:10.1016 / 0968-0004 (91) 90164-Q. ISSN 0968-0004. PMID 1776168.
- ^ גולדמן SR, Ebright RH, ניקלס BE (מאי 2009). "זיהוי ישיר של תמלילי RNA מפסיקים in vivo". מַדָע. 324 (5929): 927–8. ביבקוד:2009Sci ... 324..927G. דוי:10.1126 / science.1169237. PMC 2718712. PMID 19443781.
- ^ Revyakin A, Liu C, Ebright RH, Strick TR (נובמבר 2006). "ייזום הפלה וחניכה פרודוקטיבית על ידי RNA פולימראז כרוכים בשריטת DNA". מַדָע. 314 (5802): 1139–43. ביבקוד:2006Sci ... 314.1139R. דוי:10.1126 / science.1131398. PMC 2754787. PMID 17110577.
- ^ Raffaelle M, Kanin EI, Vogt J, Burgess RR, Ansari AZ (נובמבר 2005). "החלפת הולואנזים ושחרור סטוכסטי של גורמי סיגמא מ- RNA פולימראז in vivo". תא מולקולרי. 20 (3): 357–66. דוי:10.1016 / j.molcel.2005.10.011. PMID 16285918.
- ^ מנדל אס.אס, צ'ו סי, וודה טי, הנדה ה ', שטקין איי ג'יי, ריינברג ד' (מאי 2004). "אינטראקציות פונקציונליות של אנזים מכסת RNA עם גורמים המווסתים את בריחת היזם באופן חיובי ושלילי על ידי RNA פולימראז II". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 101 (20): 7572–7. ביבקוד:2004PNAS..101.7572M. דוי:10.1073 / pnas.0401493101. PMC 419647. PMID 15136722.
- ^ Goodrich JA, Tjian R (אפריל 1994). "גורמי שעתוק IIE ו- IIH ו- ATP הידרוליזה אישור מקדם ישיר על ידי RNA פולימראז II". תָא. 77 (1): 145–56. דוי:10.1016/0092-8674(94)90242-9. PMID 8156590. S2CID 24602504.
- ^ מילוא, רון; פיליפס, רוב. "ביולוגיה של תאים לפי המספרים: מה יותר מהיר, תעתיק או תרגום?". book.bionumbers.org. הועבר בארכיון מהמקור ב- 20 באפריל 2017. הוחזר 8 במרץ 2017.
- ^ הודג'ס ג ', בינטו ל', לובקובסקה ל ', קשלב מ', בוסטמנטה ג '(יולי 2009). "תנודות גרעיניות שולטות בדינמיקת התעתיק של RNA פולימראז II". מַדָע. 325 (5940): 626–8. ביבקוד:2009Sci ... 325..626H. דוי:10.1126 / science.1172926. PMC 2775800. PMID 19644123.
- ^ א ב פיץ V, שין J, ארליך C, Farnung L, Cramer P, Zaburdaev V, גריל SW (2016). "סידור גרעין משפיע על דינמיקת תעתיק חד מולקולה". הליכים של האקדמיה הלאומית למדעים. 113 (45): 12733–12738. דוי:10.1073 / pnas.1602764113. PMC 5111697. PMID 27791062.
- ^ ריצ'רדסון ג'יי פי (ספטמבר 2002). "סיום תלוי Rho ו- ATPases בסיום תמליל". Biochimica et Biophysica Acta (BBA) - מבנה גנים וביטוי. 1577 (2): 251–260. דוי:10.1016 / S0167-4781 (02) 00456-6. PMID 12213656.
- ^ Lykke-Andersen S, Jensen TH (אוקטובר 2007). "מסלולים חופפים מכתיבים סיום תעתיק RNA פולימראז II". ביוכימי. 89 (10): 1177–82. דוי:10.1016 / j.biochi.2007.05.007. PMID 17629387.
- ^ קרמר, פ '; כאב זרוע, ק-י .; באומלי, ש .; בנקרט, ש.; ברוקנר, פ '; בוכן, ג. Damsma, G.E .; דנגל, ש. גייגר, ש.ר. יאסיאק, ע''ג; ג'והארי, א '(יוני 2008). "מבנה פולימראזות של RNA אוקריוטי". סקירה שנתית של ביופיזיקה. 37 (1): 337–352. דוי:10.1146 / annurev.biophys.37.032807.130008. ISSN 1936-122X.
- ^ מידע על 8-הידרוקוקינולין מסיגמה-אלדריך. אוחזר בפברואר 2012
- ^ Datan E, Minn I, Peng X, He QL, Ahn H, Yu B, Pomper MG, Liu JO (2020). "מצומד גלוקוז-טריפטוליד מכוון באופן סלקטיבי לתאי סרטן בהיפוקסיה". iScience. 23 (9). דוי:10.1016 / j.isci.2020.101536. PMID 33083765.
- ^ Saxonov S, Berg P, Brutlag DL (ינואר 2006). "ניתוח כולל של הגנום של דינוקלאוטידים של CpG בגנום האנושי מבדיל בין שתי דרגות שונות של מקדמים.". הליכים של האקדמיה הלאומית למדעים של ארצות הברית של אמריקה. 103 (5): 1412–7. ביבקוד:2006PNAS..103.1412S. דוי:10.1073 / pnas.0510310103. PMC 1345710. PMID 16432200.
- ^ ציפור A (ינואר 2002). "דפוסי מתילציה של DNA וזיכרון אפיגנטי". גנים ופיתוח. 16 (1): 6–21. דוי:10.1101 / gad.947102. PMID 11782440.
- ^ פוגלשטיין B, Papadopoulos N, Velculescu VE, Zhou S, Diaz LA, Kinzler KW (מרץ 2013). "נופי הגנום הסרטני". מַדָע. 339 (6127): 1546–58. ביבקוד:2013Sci ... 339.1546V. דוי:10.1126 / science.1235122. PMC 3749880. PMID 23539594.
- ^ טסיטורה A, Cicciarelli G, Del Vecchio F, Gaggiano A, Verzella D, Fischietti M, Vecchiotti D, Capece D, Zazzeroni F, Alesse E (2014). "מיקרו-רנ"א ברשת נזק / תיקון דנ"א וסרטן". כתב העת הבינלאומי לגנומיקה. 2014: 820248. דוי:10.1155/2014/820248. PMC 3926391. PMID 24616890.
- ^ Papantonis A, Kohro T, Baboo S, Larkin JD, Deng B, Short P, Tsutsumi S, Taylor S, Kanki Y, Kobayashi M, Li G, Poh HM, Ruan X, Aburatani H, Ruan Y, Kodama T, Wada Y , יחסי ציבור קוק (נובמבר 2012). "TNFα מאותת באמצעות מפעלים מתמחים שבהם מתועתקים קידוד תגובה וגנים מירנה". כתב העת EMBO. 31 (23): 4404–14. CiteSeerX 10.1.1.919.1919. דוי:10.1038 / emboj.2012.288. PMC 3512387. PMID 23103767.
- ^ "כימיה 2006". קרן נובל. הועבר בארכיון מהמקור ב- 15 במרץ 2007. הוחזר 29 במרץ, 2007.
- ^ וו, ט (אפריל 2020). "רצף דנ"א חד גדילי בעזרת קטוקסאל לוכד את דינמיקת התעתיק הגלובלית ופעילות המשפר במקום". שיטות טבע. 17 (5): 515–523. דוי:10.1038 / s41592-020-0797-9. S2CID 214810294.
- ^ ראג 'א', ואן אודנארדן א '(אוקטובר 2008). "טבע, טיפוח או סיכוי: ביטוי גנים סטוכסטי ותוצאותיו". תָא. 135 (2): 216–26. דוי:10.1016 / j.cell.2008.09.050. PMC 3118044. PMID 18957198.
- ^ קולסניקובה IN (2000). "כמה דפוסים של מנגנון אפופטוזיס במהלך הידבקות ב- HIV". מַסָה (ברוסית). הועבר בארכיון מהמקור ב -10 ביולי 2011. הוחזר 20 בפברואר 2011.
- ^ Cesare AJ, Reddel RR (מאי 2010). "התארכות חלופית של טלומרים: מודלים, מנגנונים והשלכות". סקירת טבע גנטיקה. 11 (5): 319–30. דוי:10.1038 / nrg2763. PMID 20351727. S2CID 19224032.
